Jharkhand Board JAC Class 9 Science Important Questions Chapter 3 परमाणु एवं अणु Important Questions and Answers.
JAC Board Class 9 Science Important Questions Chapter 3 परमाणु एवं अणु
वस्तुनिष्ठ प्रश्न
1. लोहे का प्रतीक है-
(a) N
(b) Na
(c) Fe
(d) Ne
उत्तर:
(c) Fe
2. बेरियम कार्बोनेट का सूत्र है-
(a) Ba(NO3)2
(b) BaCO3
(c) BaSO4
(d) K2CO3
उत्तर:
(b) BaCO3
3. एलुमिनियम सल्फेट में ऐलुमिनियम की संयोजकता 3 है तथा सल्फेट आयन की संयोजकता 2 है। ऐलुमिनियम सल्फेट का अणुसूत्र होगा-
(a) AlSO4
(b) Al2SO4
(c) Al3(SO4)2
(d) Al2(SO4)3
उत्तर:
(d) Al2(SO4)3
4. आवोगाद्रो संख्या का मान है-
(a) 6.022 × 1023
(b) 6.023 x 1022
(c) 6.023 x 1022
(d) 6.023 x 10-22
उत्तर:
(a) 6.022 x 1023
![]()
5. एक धातु के फास्फेट का सूत्र MPO4 है। इसके क्लोराइड का अणुसूत्र होगा-
(a) MCl
(b) MCl3
(c) M2Cl3
(d) MC2
उत्तर:
(b) MCl3
6. परमाणु भार का अन्तर्राष्ट्रीय मात्रक है-
(a) C-12
(b) O-16
(c) H-1
(d) N-14
उत्तर:
(a) C-12
7. सल्फर के 32 ग्राम में कितने परमाणु हैं?
(a) 6.023 x 1022
(b) 6.023 x 10-23
(c) 6.023 x 1023
(d) 6.023 x 10-23 x 32
उत्तर:
(c) 6.023 x 1023
8. ऑक्सीजन परमाणुओं का 1 मोल होता है-
(a) 8 ग्राम
(b) 16 ग्राम
(c) ग्राम
(d) \(\frac { 1 }{ 8 }\) ग्राम
उत्तर:
(b) 16 ग्राम।
9. विद्युत आवेशित परमाणु/परमाणुओं का समूह है-
(a) परमाणु
(b) अणु
(c) मोल
(d) आयन
उत्तर:
(c) आयन।
10. 18 u जल में जल के कितने अणु होते हैं-
(a) 1
(b) 6.022 × 1023
(c) 18
(d) 36
उत्तर:
(a) 1
11. फास्फोरस है-
(a) एक परमाणुक
(b) द्विपरमाणुक
(c) त्रिपरमाणुक
(d) चतुर्परमाणुक
उत्तर:
(d) चतुर्परमाणुक
![]()
12. 0.4 मोल ऑक्सीजन परमाणु का द्रव्यमान होगा-
(a) 0.8 ग्राम
(b) 6.4 ग्राम।
(c) 3.2 ग्राम
(d) 16 ग्राम
उत्तर:
(b) 6.4 ग्राम।
13. 12 ग्राम ऑक्सीजन गैस में मोलों की संख्या है-
(a) 0.667 मोल
(b) 6.4 ग्राम
(c) 0.375 मोल
(d) 1 मोल
उत्तर:
(c) 0.375 मोल।
14. ऑक्सीजन के 4 ग्राम में अणुओं की संख्या होगी-
(a) 7.528 × 1022
(b) 7.3 x 1023
(c) 6.023 x 1023
(d) 6.023 x 10-23
उत्तर:
(a) 7.528 × 1022
15. ग्राम में व्यक्त पदार्थ का परमाण्विक द्रव्यमान कहलाता हैं-
(a) ग्राम अणु द्रव्यमान
(b) ग्राम परमाण्विक द्रव्यमान
(c) अणुभार
(d) मोल
उत्तर:
(b) ग्राम परमाण्विक द्रव्यमान।
रिक्त स्थान भरो-
- रासायनिक संयोजन के दो नियम हैं- ……………… का नियम और ……………… का नियम।
- 1m = ……………… m.
- ……………… एक अन्तर्राष्ट्रीय वैज्ञानिक संस्था है जो तत्त्वों के नामों, प्रतीकों और मात्रकों को स्वीकृति प्रदान करता है।
- किसी तत्त्व की संयोजन शक्ति उस तत्त्व की ……………… कहलाती है।
उत्तर:
- द्रव्यमान संरक्षण, स्थिर अनुपात
- 10
- IUPAC
- संयोजकता।
सुमेलन कीजिए-
| कौलम ‘क’ | कॉलम ‘ख’ |
| 1. हाइड्रोजन | (क) He |
| 2. सोडियम | (ख) H |
| 3. हीलियम | (ग) S |
| 4. सल्फर | (घ) Na |
उत्तर:
1. (ख) H
2. (घ) Na
3. (क) He
4. (ग) S
सत्य / असत्य-
- ऋण आवेशित आयन को ऋणायन कहते हैं।
- आयरन को Ir से चिह्नित करते हैं।
- सभी तत्त्वों के परमाणुओं का सापेक्ष द्रव्यमान हाइड्रोजन- 2 परमाणु के द्रव्यमान के साथ तुलना करके प्राप्त करते हैं।
- ऑक्सीजन गैस द्वि-परमाणुक अणु है।
उत्तर:
- सत्य
- असत्य
- असत्य
- सत्य।
अति लघुत्तरीय प्रश्न
प्रश्न 1.
मोल क्या है?
उत्तर:
किसी पदार्थ का मोल उसकी वह मात्रा है, जिसमें उतने ही कण उपस्थित होते हैं जितने कार्बन – 12 समस्थानिक के ठीक 12 ग्राम ( या 0.012 किग्रा) में परमाणुओं की संख्या होती है।
प्रश्न 2.
मोलर द्रव्यमान को परिभाषित कीजिए।
उत्तर:
किसी पदार्थ के एक मोल का ग्राम में व्यक्त द्रव्यमान उसका ‘मोलर द्रव्यमान’ कहलाता है।
प्रश्न 3.
मोल संकल्पना के पदों में तत्व के ग्राम परमाणु द्रव्यमान को परिभाषित कीजिए।
उत्तर:
ग्राम परमाणु द्रव्यमान अथवा एक ग्राम परमाणु किसी तत्व के एक मोल (6.022 x 1023 परमाणुओं) का द्रव्यमान होता है जिसे ग्राम में व्यक्त किया जाता है।
प्रश्न 4.
किसी तत्व के एक ग्राम परमाणु में कितने परमाणु उपस्थित होते हैं?
उत्तर:
6.022 x 1023 ( आवोगाद्रो संख्या) के तुल्य।
प्रश्न 5.
क्या सोडियम तथा कैल्सियम एक ग्राम मोल में परमाणुओं की संख्या भिन्न-भिन्न होगी?
उत्तर:
नहीं, इनमें परमाणुओं की संख्या समान होगी।
प्रश्न 6.
यौगिक के सूत्र को परिभाषित कीजिए।
उत्तर:
किसी यौगिक के अणु का इसमें उपस्थित विभिन्न तत्वों के प्रतीकों के रूप में संक्षिप्त प्रदर्शन, यौगिक का सूत्र कहलाता है। इन्हें दो रूपों में वर्गीकृत किया जा सकता है- (i) मूलानुपाती सूत्र एवं (ii) आण्विक सूत्र।
प्रश्न 7.
एक बड़े पात्र में दो बीकर रखे हैं। एक में लैड नाइट्रेट का विलयन तथा दूसरे में सोडियम सल्फेट का विलयन है। पात्र को तौल लेते हैं, फिर बीकर के विलयन परस्पर भली-भाँति मिला देते हैं। पात्र को पुनः तौल लेते हैं। क्या द्रव्यमान परिवर्तित होगा?
उत्तर:
नहीं, द्रव्यमान संरक्षण नियम के अनुसार द्रव्यमान पहले के बराबर होगा।
प्रश्न 8.
12 ग्राम मैग्नीशियम 16 ग्राम ऑक्सीजन से संयोग करके 28 ग्राम मैग्नीशियम ऑक्साइड बनाता है। इन आँकड़ों से रासायनिक संयोग से किस नियम की पुष्टि होती है?
उत्तर:
द्रव्यमान संरक्षण नियम की।
![]()
प्रश्न 9.
क्या कैल्सियम के एक मोल का भार उतना ही है जितना कार्बन के एक मोल का?
उत्तर:
नहीं, कैल्सियम के एक मोल का भार 40 ग्राम है जबकि कार्बन के एक मोल का भार 12 ग्राम होता है।
प्रश्न 10.
कार्बन तत्व के निश्चित 12 g में कितने परमाणु होते हैं? क्या इस संख्या का कोई नाम है?
उत्तर:
6.022 × 1023 परमाणु। इस संख्या को आवोगाद्रो संख्या (NA) कहा जाता है। यह एक मोल में परमाणुओं की संख्या दर्शाती है।
प्रश्न 11.
किसी पदार्थ के एक ग्राम परमाणु द्रव्यमान में कितने परमाणु उपस्थित होते हैं?
उत्तर:
6.022 × 1023 परमाणु।
प्रश्न 12.
किसी पदार्थ के एक ग्राम आण्विक द्रव्यमान में कितने परमाणु उपस्थित होते हैं?
उत्तर:
6.0221023 परमाणु।
प्रश्न 13.
निम्नलिखित यौगिकों के रासायनिक सूत्र लिखिए – (i) सल्फ्यूरिक अम्ल तथा (ii) कैल्सियम हाइड्रॉक्साइड
उत्तर:
- H2 SO4 तथा
- Ca(OH)2.
प्रश्न 14.
निम्नलिखित यौगिकों के नाम लिखिए- (i) (NH4)2SO4 तथा (ii) Na2S
उत्तर:
- अमोनियम सल्फेट तथा
- सोडियम सल्फाइड।
प्रश्न 15.
(i) Ag2 O तथा
(ii) Cus यौगिकों के नाम बताइए।
उत्तर:
(i) सिल्वर ऑक्साइड तथा
(ii) कॉपर सल्फाइड।
प्रश्न 16.
He के 12.044 x 1023 परमाणुओं को मोल में परिवर्तित कीजिए।
हल:
∵ 6.022 × 1023 परमाणु = 1 मोल
12.044 x 1023 परमाणु 2 मोल
प्रश्न 17.
किस भारतीय दार्शनिक ने परमाणु को परिभाषित किया था?
उत्तर:
महर्षि कणाद।
प्रश्न 18.
रासायनिक संयोजन के नियमों को सर्वप्रथम किसने प्रतिपादित किया था?
उत्तर:
एन्टोनी एल० लेवॉशिये (Antonie L Lavoisier)।
प्रश्न 19.
द्रव्यमान संरक्षण क्या है?
उत्तर:
किसी रासायनिक अभिक्रिया में द्रव्यमान का न तो सृजन किया जा सकता है न ही विनाश।
प्रश्न 20.
क्या मोल द्वारा केवल परमाणुओं को गिना जाता है?
उत्तर:
नहीं, मोल अतिसूक्ष्म स्तर पर कणों (जैसे- परमाणुओं, अणुओं, आयनों, इलेक्ट्रॉनों आदि) को गिनने की इकाई होती है।
प्रश्न 21.
परमाणुकता क्या है?
उत्तर:
किसी अणु में उपस्थित परमाणुओं की संख्या उसकी परमाणुकता कहलाती है।
प्रश्न 22.
त्रिपरमाणुक अणु में कितने परमाणु होते हैं?
उत्तर:
तीन।
प्रश्न 23.
आण्विक सूत्र क्या है?
उत्तर:
वह सूत्र जिसमें किसी यौगिक में उपस्थित विभिन्न तत्वों के परमाणुओं की एक निश्चित (exact) संख्या होती है।
प्रश्न 24.
आयन क्या है?
उत्तर:
वह आवेशित कण जिस पर धन अथवा ऋण आवेश हो सकता है।
प्रश्न 25.
धनायनों के चार उदाहरण दीजिए।
उत्तर:
Na+, K+, Ca2+, Mg2+
प्रश्न 26.
ऋणायनों के पाँच उदाहरण दीजिए।
उत्तर:
Cl–, Br–, F–, F, O2- or O—
प्रश्न 27.
आयनिक यौगिक क्या है?
उत्तर:
जिनमें आयन विद्यमान होते हैं उदाहरण : NaCl, KCI
प्रश्न 28.
तत्वों के प्रतीक क्या होते हैं?
उत्तर:
तत्वों के नामों के संक्षिप्त रूप ‘प्रतीक’ कहलाते है।
![]()
प्रश्न 29.
नाइट्रोजन, सल्फर तथा यूरेनियम के प्रतीक बताइए।
उत्तर:
N, S तथा U.
प्रश्न 30.
परमाणु का आकार सामान्यतः किसमें मापा जाता है?
उत्तर:
नैनोमीटर (nm) में।
प्रश्न 31.
amu हेतु IUPAC का नवीनतम अनुमोदन कौन-सा है?
उत्तर:
u (यूनीफाइड)।
प्रश्न 32.
NaCl का इकाई सूत्र द्रव्यमान क्या है?
उत्तर:
1 × 23 + 35.5 = 58.5 u.
प्रश्न 33.
किसी आयनिक यौगिक का सूत्र ज्ञात करने में कौन सहायता करता है?
उत्तर:
आयनों पर उपस्थित आवेश।
प्रश्न 34.
आवोगाद्रो संख्या क्या है?
उत्तर:
6.022 x 1023।
प्रश्न 35.
एक मोल ऑक्सीजन परमाणुओं का द्रव्यमान क्या है?
उत्तर:
16 ग्राम।
प्रश्न 36.
Al3+ तथा SO22- आयनों से बने यौगिक का सूत्र लिखिए।
उत्तर:
Al2(SO4)3.
प्रश्न 37.
“भिन्न-भिन्न तत्वों के परमाणु परस्पर छोटी पूर्ण संख्या के अनुपात में संयोग कर यौगिक निर्मित करते।” यह अभिगृहीत किस नियम से सम्बन्धित है?
उत्तर:
द्रव्यमान संरक्षण के नियम से।
लघु एवं दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
डॉल्टन का परमाणु सिद्धान्त क्या है?
उत्तर:
डॉल्टन के परमाणु सिद्धान्त के मुख्य अंश निम्नलिखित हैं-
- सभी द्रव्य अति सूक्ष्म कणों से मिलकर बने होते हैं, जिन्हें परमाणु कहते हैं।
- परमाणु अविभाज्य होता है अर्थात् इसे आगे विभाजित नहीं किया जा सकता है।
- परमाणु अविनाशी होता है। इसे रासायनिक क्रिया द्वारा न तो नष्ट किया जा सकता है और न ही उत्पन्न किया जा सकता है।
- एक तत्व के सभी परमाणु हर दृष्टि से समान होते हैं परन्तु दूसरे तत्व से भिन्न होते हैं। उनका भार निश्चित होता है।
- विभिन्न तत्वों के परमाणुओं के भार व गुण बराबर होते हैं।
- विभिन्न तत्वों के परमाणु सरल व निश्चित संयोग करके यौगिक बनाते हैं।
प्रश्न 2.
डॉल्टन के परमाणु सिद्धान्त के अनुसार स्थिर ‘के नियम की व्याख्या कीजिए।
उत्तर:
डॉल्टन के परमाणु सिद्धान्त के अनुसार, प्रत्येक तत्व छोटे कर्णो से बना होता है, जिन्हें परमाणु कहते हैं। प्रत्येक परमाणु का निश्चित भार होता है। विभिन्न तत्वों के परमाणु संयुक्त होकर यौगिक बनाते हैं और यौगिक में प्रत्येक तत्व के परमाणुओं की संख्या तथा प्रकार निश्चित होते हैं। अब क्योंकि किसी यौगिक के प्रत्येक तत्व के परमाणुओं की संख्या, परमाणुओं के प्रकार तथा परमाणुओं के भार निश्चित होते हैं, इसलिए यौगिक में सदैव समान तत्व भारानुसार उसी अनुपात में परस्पर संयुक्त होंगे और यही स्थिर अनुपात का नियम है।
प्रश्न 3.
अणु व परमाणु में अन्तर बताइये।
उत्तर:
अन्तर
| अणु (Molecule) | परमाणु (Atom) |
| 1. यह दो या दो से अधिक परमाणुओं से मिलकर बनता है : इसमें पदार्थ के गुण विद्यमान होते हैं। | 1. यह किसी पदार्थ का वह छोटा कण है, जो रासायनिक अभिक्रिया में भाग ले सकता है। |
| 2. यह मुक्त अवस्था में रह सकता है। | 2. यह मुक्त अवस्था में नहीं रह सकता है। |
प्रश्न 4.
ग्राम परमाणु द्रव्यमान को परिभाषित कीजिए तथा इसका महत्त्व बताइये।
उत्तर:
किसी पदार्थ की वह मात्रा जिसका ग्रामों में द्रव्यमान उसके परमाणु द्रव्यमान के बराबर हो, उस पदार्थ का ग्राम परमाणु द्रव्यमान कहलाता है। दूसरे शब्दों में, ग्रामों में व्यक्त परमाणु द्रव्यमान को ग्राम परमाणु द्रव्यमान कहते हैं। ऑक्सीजन का परमाणु द्रव्यमान 16 है, अतः ऑक्सीजन का ग्राम परमाणु द्रव्यमान 16 ग्राम होगा। किसी पदार्थ का ग्राम परमाणु द्रव्यमान उसके एक मोल परमाणुओं का द्रव्यमान होता है।
प्रश्न 5.
ग्राम अणु द्रव्यमान को परिभाषित करिए तथा इसका महत्त्व बताइए।
उत्तर:
किसी पदार्थ की वह मात्रा जिसका ग्राम में द्रव्यमान उसके अणु द्रव्यमान के बराबर हो, उस पदार्थ का ग्राम अणु द्रव्यमान कहलाता है। दूसरे शब्दों में, ग्रामों में व्यक्त अणु द्रव्यमान को ग्राम अणु द्रव्यमान कहते हैं।
ऑक्सीजन (O2) का अणु द्रव्यमान 32 अतः इसका ग्राम अणु द्रव्यमान 32 ग्राम होगा। किसी पदार्थ का ग्राम अणु द्रव्यमान उसके एक मोल (6.022 x 1023) अणु का द्रव्यमान होता है।
प्रश्न 6.
परमाणु द्रव्यमान इकाई (amu) से आप क्या समझते हैं?
उत्तर:
परमाणु द्रव्यमान इकाई (amu) आजकल परमाणु द्रव्यमान को कार्बन-12 परमाणु (6C12) के द्रव्यमान के सापेक्ष व्यक्त किया जाता है। परमाणु द्रव्यमान मात्रक को संक्षेप में amu द्वारा प्रदर्शित करते हैं। कार्बन-12 के एक परमाणु का द्रव्यमान स्वेच्छा से ठीक 12 amu मान लिया गया है; अत: कार्बन-12 के एक परमाणु के द्रव्यमान के बारहवें (1/12) भाग को परमाणु द्रव्यमान इकाई कहते हैं।
परमाणु द्रव्यमान इकाई = \(\frac { 1 }{ 12 }\) x कार्बन-12 परमाणु का द्रव्यमान (1 amu- x mass of 6C12 atom )
कार्बन 12 समस्थानिक के एक परमाणु का वास्तविक द्रव्यमान 1.9926 × 10-23 ग्राम होता है जो 12 amu के बराबर होता है।
अत: 1 amu = \(\frac{1.9926 \times 10^{-23}}{12}\) = 1.66 × 10-24 ग्राम
1.66 × 10-24 ग्राम को amu का ग्राम तुल्यांक (gram equivalent) कहते हैं।
तत्वों के विभिन्न समस्थानिकों के परमाणुओं के द्रव्यमान तथा सब परमाण्विक कणों के द्रव्यमान प्राय: amu में व्यक्त किए जाते हैं। उदाहरणार्थ, 7N14 के एक परमाणु का द्रव्यमान 14.0032 amu है। एक इलेक्ट्रॉन का द्रव्यमान 0.0005486 amu है।
प्रश्न 7.
निम्नलिखित को परिभाषित कीजिए-
(i) परमाणु
(ii) अणु
(iii) अणुसूत्र।
उत्तर:
(i) परमाणु – परमाणु किसी तत्व का वह छोटे-से छोटा कण है जो रासायनिक अभिक्रिया में भाग लेता है और स्वतन्त्र अवस्था में नहीं रह सकता है। दूसरे शब्दों में, परमाणु किसी तत्व का वह सूक्ष्मतम कण है जो सभी रासायनिक और भौतिक परिवर्तनों में अपनी रासायनिक पहचान बनाए रखता है।
(ii) अणु – अणु किसी तत्व या यौगिक वह सूक्ष्मतम कण है जिसका सामान्य अवस्था में अकेला या स्वतन्त्र अस्तित्व होता है और वह इस पदार्थ (तत्व या यौगिक) के सभी गुणों को दर्शाता है। एक अणु एक, दो या अधिक परमाणुओं से मिलकर बना हो सकता है। उदाहरण के लिए Ar या He (एकपरमाण्विक) H2, N2, HCl (द्विपरमाण्विक) H2O, CO2 (त्रिपरमाण्विक) तथा NH3, P4 (चतुर्परमाण्विक) इत्यादि।
(iii) अणुसूत्र – आण्विक सूत्र (अणुसूत्र ) वह सूत्र है जो किसी यौगिक के अणु में उपस्थित विभिन्न तत्वों के परमाणुओं की वास्तविक संख्या को बताता है। उदाहरण के लिए हाइड्रोजन परॉक्साइड में हाइड्रोजन के 2 परमाणु तथा ऑक्सीजन के 2 परमाणु उपस्थित हैं और इसका अणुसूत्र H2 O2 है
प्रश्न 8.
निम्नलिखित को आप कैसे परिभाषित करेंगे?
(अ) परमाणु द्रव्यमान
(ब) आण्विक द्रव्यमान।
उत्तर:
(अ) परमाणु द्रव्यमान कार्बन के एक परमाणु के भार के 1/12 भाग से किसी तत्व का एक परमाणु जितने गुना भारी होता है, वह द्रव्यमान उस तत्व का परमाणु द्रव्यमान कहलाता है, जबकि एक कार्बन परमाणु का भार 12 लिया गया हो।
(ब) आण्विक द्रव्यमान किसी पदार्थ के अणु में उपस्थित सभी परमाणुओं के कुल द्रव्यमान के योग को आण्विक द्रव्यमान कहते हैं।
![]()
प्रश्न 9.
तत्व के प्रतीक का क्या महत्त्व होता है?
उत्तर:
तत्व के प्रतीक के महत्त्व निम्नवत् हैं-
- प्रत्येक तत्व का नाम प्रदर्शित करता है।
- प्रत्येक तत्व के एक परमाणु को प्रदर्शित करता है।
- प्रत्येक तत्व के परमाणुओं के एक मोल को व्यक्त करता है।
- प्रत्येक तत्व के निश्चित द्रव्यमान का प्रतिनिधित्व करता है।
प्रश्न 10.
परमाणु तथा आयन में अन्तर स्पष्ट कीजिए।
उत्तर:
परमाणु तथा आयन में अन्तर
| परमाणु | आयन |
| 1. यह विद्युत उदासीन होता है। | यह विद्युत आवेशित होता है। |
| 2. परमाणुओं का इलेक्ट्रॉ-निक विन्यास अस्थायी होता है (अक्रिय गैसों को छोड़कर) | इलेक्ट्रॉनिक विन्यास स्थायी होते हैं। |
| 3. स्वतन्त्र अवस्था में नहीं रह सकता है। | स्वतन्त्र अवस्था में रह सकता है। |
प्रश्न 11.
निम्नलिखित यौगिकों के सूत्र लिखिए-
- फेरिक सल्फेट
- मैग्नीशियम फॉस्फाइट
- ऐलुमिनियम कार्बोनेट
- सोडियम थायोसल्फेट
- कैडमियम नाइट्रेट
- क्रोमियम ऑक्साइड
- सोडियम सिलिकेट
- स्ट्रॉन्शियम बाइकार्बोनेट
- पोटैशियम जिंकेट
- कैल्सियम बोरेट
उत्तर:
- (i) Fe2 (SO4)3
- ) MgHPO3
- Al2(CO3)3
- Na2S2O3
- Cd(NO3)2
- Cr2O3
- Na2 SiO3
- Sr (HCO3)2
- K2ZnO2
- Ca3 (BO3)2
प्रश्न 12.
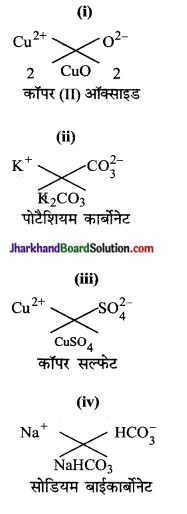
निम्नलिखित के द्वारा बने यौगिकों के सूत्र तथा नाम बताइए-
(i) Cu2+ तथा O2-
(ii) K+ तथा CO32-
(iii) Cu2+ तथा SO42-
(iv) Na+ तथा HCO3–
उत्तर:
प्रश्न 13.
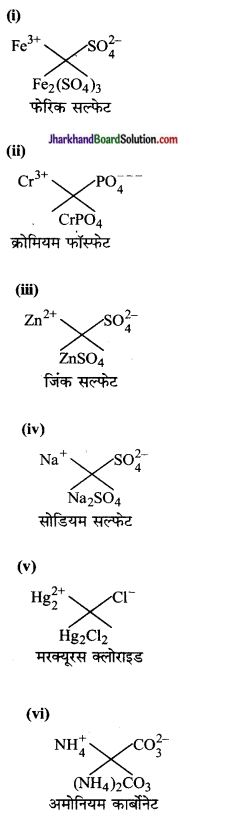
निम्नलिखित के द्वारा बने यौगिकों के सूत्र तथा नाम लिखिए-
(i) Fe3+ तथा SO42-
(ii) Cr3+ तथा PO43-
(iii) Zn2+ तथा SO42-
(iv) Na+ तथा SO42-
(v) Hg22+ तथा Cr–
(vi) NH4+ CO32-
उत्तर:
प्रश्न 14.
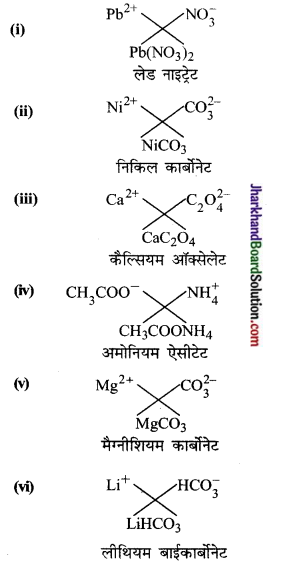
निम्नलिखित के द्वारा बने यौगिकों के सूत्र तथा नाम लिखिए-
(i) प्लम्बस आयन तथा नाइट्रेट आयन
(ii) निकिल आयन तथा कार्बोनेट आयन
(iii) कैल्सियम आयन तथा ऑक्सेलेट आयन
(iv) अमोनियम आयन तथा ऐसीटेट आयन
(v) मैग्नीशियम आयन तथा कार्बोनेट आयन
(vi) लीथियम आयन तथा बाइकार्बोनेट आयन
उत्तर:
प्रश्न 15.
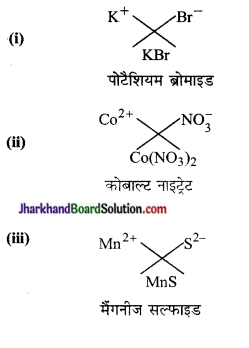
निम्नलिखित के द्वारा बने यौगिकों के सूत्र तथा नाम लिखिए-
(i) पोटैशियम आयन तथा ब्रोमाइड आयन
(ii) कोबाल्ट आयन तथा नाइट्रेट आयन
(iii) मैंगनीज आयन तथा सल्फाइड आयन
उत्तर:
प्रश्न 16.
निम्नलिखित यौगिकों के सूत्र लिखिए-
(i) जिंक फॉस्फेट
(ii) अमोनियम ऑक्सेलेट
(iii) मरक्यूरिक क्लोराइड
(iv) मरक्यूरस नाइट्रेट
(v) ऐलुमिनियम फ्लुओराइड
(vi) क्रोमियम क्लोराइड
(vii) लेड ऐसीटेट
(viii) क्यूप्रस ऑक्साइड
(ix) कॉपर (II) फॉस्फेट
(x) निकिल नाइट्रेट
उत्तर:
(i) Zn3(PO4)2
(ii) (NH4)2C2O4
(iii) HgCl2
(iv) Hg2(NO3)2
(v) AlF3
(vi) Cr Cl3
(vii) Cu2O
(ix) Cu3 (PO4)2
(x) Ni(NO3)2
प्रश्न 17.
निम्नलिखित यौगिकों के नाम लिखिए-
(i) Na2 SO4
(ii) (NH4)2SO4
(iii) Mn(OH)2
(iv) NaOH
(v) ZnSO4
(vi) Cocl2
(vii) KClO3
(viii) KBr
(ix) FeCl3
(x) Al2O3
(xi) (NH4)2Cr2O7
उत्तर:
(i) सोडियम सल्फेट
(ii) अमोनियम सल्फेट
(iii) मँगनीज हाइड्रॉक्साइड
(iv) सोडियम हाइड्रॉक्साइड
(v) जिंक सल्फेट
(vi) कोबाल्ट क्लोराइड
(vii) पोटैशियम क्लोरेट
(viii) पोटैशियम ब्रोमाइड
(ix) फेरिक क्लोराइड
(x) ऐलुमिनियम ऑक्साइड
(xi) अमोनियम डाइक्रोमेट
(xii) सिल्वर नाइट्रेट।
प्रश्न 18.
आण्विक द्रव्यमान क्या है? इसकी विभिन्न परिभाषाएँ देते हुए ग्राम अणुभार को भी स्पष्ट करें।
उत्तर:
आण्विक द्रव्यमान “किसी तत्व अथवा यौगिक का वह छोटे-से-छोटा कण जिसमें उस तत्व अथवा यौगिक के सभी गुण विद्यमान हों तथा जो स्वतन्त्र अवस्था में रह सकता हो, अणु कहलाता है।” किसी पदार्थ के एक अणु का द्रव्यमान बहुत ही कम होता है और इसको ज्ञात करना कठिन एवं असुविधाजनक होता है।
अतः अणु का वास्तविक द्रव्यमान को ज्ञात न करके हम आण्विक द्रव्यमान को औसत सापेक्षिक द्रव्यमान के रूप में ज्ञात कर सकते हैं किसी पदार्थ (तत्व या यौगिक) के सापेक्ष आण्विक द्रव्यमान को व्यक्त करने के लिए C-12 समस्थानिक का प्रयोग किया जाता है। इस प्रकार पदार्थ का आण्विक द्रव्यमान इस प्रकार परिभाषित किया जा सकता हैं-
किसी पदार्थ का आण्विक द्रव्यमान वह संख्या है जो यह प्रदर्शित करती है कि इस पदार्थ का एक अणु कार्बन- 12 (समस्थानिक) के एक परमाणु के बारहवें अंश से कितने गुना भारी है।

ग्राम आण्विक द्रव्यमान – ” जब आण्विक द्रव्यमान को ग्राम में प्रकट किया जाता है, तो वह ग्राम आण्विक द्रव्यमान कहलाता है।” जैसे- क्लोरीन का आण्विक द्रव्यमान 71 है और ग्राम आण्विक द्रव्यमान 71 ग्राम हैं।
प्रश्न 19.
मोल संकल्पना क्या है? इसकी आवश्यकता पर प्रकाश डालते हुए मोलर द्रव्यमान को परिभाषित कीजिए।
उत्तर:
मोल संकल्पना रसायन शास्त्र में अतिसूक्ष्म स्तर पर कण (जैसे-परमाणुओं, अणुओं, कण, इलेक्ट्रॉनों आदि) की संख्या ज्ञात करने के लिए रसायनज्ञों को एक मानक मात्रक की आवश्यकता अनुभव हुई। इसलिए मोल संकल्पना का प्रादुर्भाव हुआ। इसके अनुसार,
“किसी पदार्थ का एक मोल उसकी वह मात्रा है जिसमें उतने ही कण उपस्थित होते हैं, जितने कार्बन – 12 समस्थानिक के ठीक 12 ग्राम (या 0.012 ग्राम) में परमाणुओं की संख्या होती है।”
यहाँ यह तथ्य महत्त्वपूर्ण है कि किसी पदार्थ के एक मोल में कर्णों की संख्या सदैव समान होगी, भले ही वह कोई भी पदार्थ हो। इस संख्या के सही निर्धारण के लिए कार्बन-12 परमाणु का द्रव्यमान द्रव्यमान स्पेक्ट्रममापी द्वारा ज्ञात किया गया जिसका मान 1.992648 x 10-23 ग्राम प्राप्त हुआ। कार्बन के 1 मोल का द्रव्यमान 12 ग्राम होता है; अतः कार्बन के 1 मोल में परमाणुओं की संख्या इस प्रकार होगी-

1 मोल में कणों की यह संख्या अत्यन्त महत्त्वपूर्ण है। इसे ‘ आवोगाद्रो संख्या’ कहते हैं तथा ‘N’ या ‘N’ से व्यक्त करते हैं।
मोल संकल्पना की आवश्यकता परमाणु और अणु आकार में अत्यन्त छोटे होते हैं तथा किसी पदार्थ की बहुत कम मात्रा में भी इनकी संख्या बहुत अधिक होती है, इतनी बड़ी संख्याओं के साथ कार्य करने के लिए इतने ही परिमाण के एक मात्रक की आवश्यकता होती है। मोल संकल्पना के अनुसार 12 ग्राम कार्बन में 6.022 1023 ( आवोगाद्रो संख्या) कार्बन परमाणु होते हैं। चूँकि इस कणों को गिनना सम्भव नहीं है। अतः इनकी संख्या को मोल में व्यक्त करके कार्य करना सरल हो जाता है।
उदाहरणस्वरूप-
1 मोल में ऑक्सीजन परमाणुओं की संख्या = 6.022 × 1023
∴ 3 मोल में ऑक्सीजन परमाणुओं की संख्या
= 3 × 6.022 × 1023
= 1.81 x 1024 परमाणु
उपर्युक्त उदाहरण से स्पष्ट है कि ऑक्सीजन परमाणुओं की संख्या 1.81 1034 में व्यक्त करना अपेक्षाकृत कठिन कार्य है, अपितु इन्हें 3 मोल ऑक्सीजन परमाणु के रूप में व्यक्त करना अत्यन्त सरल है।
मोल द्रव्यमान – मोल को परिभाषित करने के पश्चात् किसी पदार्थ या उसके घटकों के एक मोल के द्रव्यमान को सरलता से प्राप्त किया जा सकता है।
“किसी पदार्थ के एक मोल के ग्राम में व्यक्त द्रव्यमान को उसका ‘मोलर द्रव्यमान’ कहते हैं।”
ग्राम में व्यक्त मोलर द्रव्यमान संख्यात्मक रूप से परमाणु द्रव्यमान या आण्विक द्रव्यमान या सूत्र द्रव्यमान के बराबर होता है।
उदाहरणार्थ-
जल का मोलर द्रव्यमान = 18.02 ग्राम
सोडियम क्लोराइड का मोलर द्रव्यमान = 58.5 ग्राम
आंकिक प्रश्न
प्रश्न 1.
CaCO3 के आण्विक द्रव्यमान की गणना कीजिए।
(Ca = 40u, C 12u, O = 16u)
हल:
CaCO3 का आण्विक द्रव्यमान
= (1 × 40) + (1 x 12) + ( 3 x 16 )
= 40 + 12 + 48 = 100u
प्रश्न 2.
ग्लूकोस (C6H12O6) के आण्विक द्रव्यमान की गणना कीजिए। (C = 12u, H = 1u, O = 16u)
हल:
C6H12O6 का आण्विक द्रव्यमान
=(6 × 12) + (12 × 1) + (6 × 16)
= 72 + 12 + 96 – 180 u
प्रश्न 3.
सल्फ्यूरिक अम्ल (H2SO4) के आण्विक द्रव्यमान की गणना कीजिए।
हल:
H2SO4 का आण्विक द्रव्यमान
= (2 × 1) + (1 × 32) + (4 × 16)
= 2 + 32 + 64
= 98u
![]()
प्रश्न 4.
H3PO4 के सूत्र द्रव्यमान की गणना करो। (H = 1 u, P = 31u, O = 16u)
हल:
H3 PO4 का सूत्र द्रव्यमान
= (3 × 1) + 31 + ( 4 x 16)u
= (3 + 31 + 64) u
= 98u
प्रश्न 5.
सिद्ध कीजिए कि निम्नलिखित आँकड़े स्थिर अनुपात के नियम की पुष्टि करते हैं। कॉपर मोनोऑक्साइड के दो विभिन्न नमूनों में कॉपर के द्रव्यमान निम्नलिखित थे –
(i) 1.26 ग्राम कॉपर, 1.42 ग्राम ऑक्साइड में
(ii) 1.008 ग्राम कॉपर, 1.136 ग्राम ऑक्साइड में। (कॉपर का परमाणु भार 63, ऑक्सीजन का परमाणु भार – 16)
हल:
पहले नमूने में,
कॉपर मोनोऑक्साइड का द्रव्यमान = 1.42 ग्राम
कॉपर का द्रव्यमान = 1.26 ग्राम
∴ ऑक्सीजन का द्रव्यमान = (1.42 – 1.26) ग्राम
= 0.16 ग्राम
अत: कॉपर तथा ऑक्सीजन का अनुपात = 1.26 : 0.16 = 7.875 : 1
दूसरे नमूने में,
कॉपर मोनोऑक्साइड का द्रव्यमान = 1.136 ग्राम
कॉपर का द्रव्यमान = 1.008 ग्राम
∴ ऑक्सीजन का द्रव्यमान = (1.136 – 1.008) ग्राम
= 0.128 ग्राम
अत: कॉपर तथा ऑक्सीजन का अनुपात
= 1.008 : 0.128 ग्राम
= 7.875 : 1
चूँकि इन दोनों नमूनों में कॉपर तथा ऑक्सीजन के द्रव्यमानों के अनुपात 7.8751 से प्रदर्शित होता है कि कॉपर मोनोऑक्साइड में उसके अवयवी तत्वों के द्रव्यमानों का अनुपात स्थिर होता है अतः इन आँकड़ों से स्थिर अनुपात के नियम की पुष्टि होती है।
प्रश्न 6.
एक प्रयोग में 2.4 ग्राम आयरन ऑक्साइड को हाइड्रोजन द्वारा पूर्णतया अपचयित करने पर 1.68 ग्राम आयरन प्राप्त होता है। दूसरे प्रयोग में 2.90 ग्राम आयरन ऑक्साइड अपचयित होने पर 2.03 ग्राम आयरन देता है। इन प्रयोगों के परिणामों से स्थिर अनुपात का नियम सिद्ध कीजिए।
हल:
पहले प्रयोग में,
आयरन ऑक्साइड का द्रव्यमान = 2.40 ग्राम
आयरन का द्रव्यमान = 1.68 ग्राम
अत: संयुक्त ऑक्सीजन का द्रव्यमान
= (2.40- 1.68) ग्राम
= 0.72 ग्राम
अब आयरन एवं ऑक्सीजन के द्रव्यमान का अनुपात
= 1.68 : 0.72 = 7 : 3
दूसरे प्रयोग में,
आयरन ऑक्साइड का द्रव्यमान = 2.90 ग्राम
आयरन का द्रव्यमान = 2.03 ग्राम
अत: संयुक्त ऑक्सीजन का द्रव्यमान
= (2.90-2.03) ग्राम = 0.87 ग्राम
आयरन एवं ऑक्सीजन के द्रव्यमानों का अनुपात
= 2.03 : 0.87 = 7 : 3
चूँकि दोनों प्रयोगों में आयरन ऑक्साइड में आयरन तथा ऑक्सीजन के द्रव्यमानों के अनुपात 7 3 से स्पष्ट है कि आयरन ऑक्साइड में उसके अवयवी तत्वों के द्रव्यमानों का अनुपात स्थिर होता है। अतः इससे स्थिर अनुपात के नियम की पुष्टि होती है।
प्रश्न 7.
एक प्रयोग में तत्व A के 12 ग्राम तत्व B के 16 ग्राम से संयोग करके एक यौगिक बनाते हैं। दूसरे प्रयोग में तत्व A के 3 ग्राम, तत्व B के 4 ग्राम से संयोग करके यौगिक बनाते हैं। कारण सहित बताइए कि इन आँकड़ों से रासायनिक संयोग के किस नियम का सत्यापन होता है?
हल:
प्रथम प्रयोग में, A: B = 12:16 = 3:4
दूसरे प्रयोग में, A:B = 3:4
A तथा B के द्रव्यमानों में समान अनुपात होने के कारण स्पष्ट है कि उपर्युक्त आँकड़े स्थिर अनुपात के नियम की पुष्टि करते हैं।
प्रश्न 8.
निम्नलिखित के मोलर द्रव्यमान की गणना कीजिए तथा उनकी उपयुक्त मात्रक इकाइयाँ दीजिए-
C2 H5 OH, PCl5
हल:
(i) C2 H5 OH का मोलर द्रव्यमान
= [ 2 × 12 + 5 × 1 + 16 + 1] amu
= 24 + 5 + 16 + 1 46 amu
= 46 ग्राम / मोल
(ii) PCI का मोलर द्रव्यमान = [31 + 5 x 35.5] ग्राम / मोल
= 31 + 177.5 ग्राम/मोल
= 208.5 ग्राम / मोल
प्रश्न 9.
निम्नलिखित के आण्विक द्रव्यमान का परिकलन कीजिए- (i) CH2Cl2
(ii) H2O2
हल:
(i) CH2Cl2 का आण्विक द्रव्यमान
= [12 + 2 × 1 + 2 × 35.5]
= 12 + 2 + 71
= 85u
(ii) H2 O2 का आण्विक द्रव्यमान
= [2 × 1 + 2 × 16]
= 2 + 32
= 34.u
प्रश्न 10.
नीचे दिए गए यौगिकों के सूत्र द्रव्यमान का परिकलन कीजिए-
(i) MgO
(ii) AlCl3
हल:
(i) MgO का सूत्र द्रव्यमान = [24 + 16] = 40 ग्राम
(ii) AlCl3 का सूत्र द्रव्यमान = [27 + 3 × 35.5]
= 27 + 106.5 = 133.5 ग्राम
प्रश्न 11.
सोडियम कार्बोनेट डेकाहाइड्रेट (Na2 CO3.10H2O) एक महत्त्वपूर्ण औद्योगिक रसायन है। उसके सूत्र द्रव्यमान का परिकलन कीजिए।
हल:
Na2 CO3.10H2O का सूत्र द्रव्यमान
= [(2 × 23) + 12 + (316) +10 (21) + 163] ग्राम
= [46 + 12 + 48 + 10 (18)] ग्राम
= [46 + 12 + 48 + 180] ग्राम
= 286 ग्राम
प्रश्न 12.
निम्नलिखित में से प्रत्येक में परमाणुओं की संख्या ज्ञात कीजिए-
(i) 52 मोल He
(ii) 52 u He
(iii) 52 ग्राम He
हल:
(i) 1 मोल He में परमाणुओं की संख्या
= 6.022 x 1023
∴ 52 मोल He में परमाणुओं की संख्या
= 6.022 × 1023 x 52
= 3.13 x 1025 परमाणु
(ii) He का परमाणु द्रव्यमान – 4 u
∵ 4 u द्रव्यमान He के एक परमाणु का द्रव्यमान है,
∴ 52u द्रव्यमान होगा \(\frac { 52 }{ 4 }\) He परमाणु का = 13 परमाणु
(iii) He का ग्राम परमाणु द्रव्यमान = 4g
4 ग्राम He में परमाणुओं की संख्या = 6.022 x 1023
∴ 52 ग्राम He में परमाणुओं की संख्या
= 6.022 × 1023 x \(\frac { 52 }{ 4 }\)
= 7.83 x 1024 परमाणु
प्रश्न 13.
प्राप्त कार्बन डाइऑक्साइड की मात्रा का परिकलन कीजिए जब-
(i) 1 मोल कार्बन को हवा में जलाया जाता है, और
(ii) 1 मोल कार्बन को 16 ग्राम ऑक्सीजन में जलाया जाता है।
हल:
हवा में कार्बन को जलाने का रासायनिक समीकरण निम्नलिखित है-

(i) जब 1 मोल कार्बन को वायु में जलाया जाता है-
1 मोल कार्बन जलकर CO2 उत्पन्न करेगा = 1 मोल = 44 ग्राम
(ii) जब 1 मोल कार्बन को 16 ग्राम ऑक्सीजन में जलाया जाता है-
1 मोल कार्बन के लिए आवश्यक ऑक्सीजन = 32 ग्राम = 1 मोल
परन्तु ऑक्सीजन का उपलब्ध द्रव्यमान = 16 ग्राम = \(\frac { 1 }{ 2 }\) मोल
अतः ऑक्सीजन सीमित मात्रा में है अर्थात् यह Limit-ing reagent है।
∴ उत्पन्न CO2 का द्रव्यमान = \(\frac { 1 }{ 2 }\) मोल = 22 ग्राम
प्रश्न 14.
एथेन (C2H6) के तीन मोलों में निम्नलिखित का परिकलन कीजिए-
(i) कार्बन परमाणुओं के मोलों की संख्या,
(ii) हाइड्रोजन परमाणुओं के मोलों की संख्या,
(iii) एथेन के अणुओं की संख्या।
हल:
(i) एथेन (C2H6) के 1 मोल में कार्बन परमाणुओं के 2 मोल उपस्थित हैं,
अत: एथेन (C2H6) के 3 मोलों में कार्बन परमाणुओं के 2 × 3 = 6 मोल उपस्थित होंगे।
(ii) एथेन (C2H6) के 1 मोल में हाइड्रोजन परमाणुओं के 6 मोल उपस्थित हैं।
अतः एथेन (C2H6) के 3 मोलों में हाइड्रोजन परमाणुओं के 3 × 6 = 18 मोल उपस्थित होंगे।
(iii) 1 मोल C, H में अणुओं की संख्या
= 6.022 × 1023
∵ 3 मोलो C2H6 में अणुओं की संख्या
= 3 × 6.022 × 1023
= 1.81 × 1024 अणु