Jharkhand Board JAC Class 9 Science Solutions Chapter 4 परमाणु की संरचना Textbook Exercise Questions and Answers.
JAC Board Class 9 Science Solutions Chapter 4 परमाणु की संरचना
Jharkhand Board Class 9 Science परमाणु की संरचना Textbook Questions and Answers
प्रश्न 1.
इलेक्ट्रॉन, प्रोटॉन और न्यूटॉन के गुणों की तुलना कीजिए।
उत्तर:
इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के गुणों की तुलना
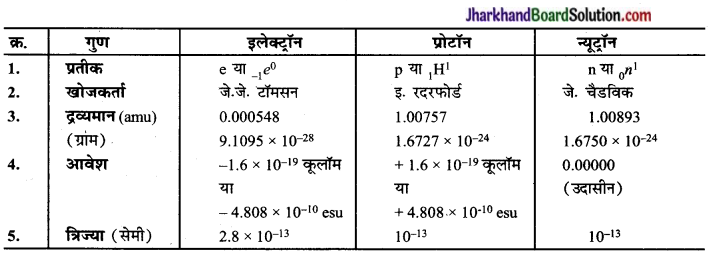
प्रश्न 2.
जे. जे. टॉमसन के परमाणु मॉडल की क्या सीमाएँ थीं?
उत्तर:
जे. जे. टॉमसन ने परमाणु का एक मॉडल दिया, जिसमें इलेक्ट्रॉन परमाणु के पूरे आयतन में एक समान रूप से वितरित रहते हैं। जैसा कि नीचे चित्र में दिखाया गय है। यह माना गया कि परमाणु का द्रव्यमान समान रूप से वितरित रहता है। यह स्थापित किया गया कि परमाणु का आकार 10-10 या 1Å होता है।
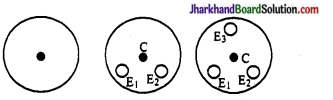
जे. जे टामसन का परमाणु मॉडल दूसरे वैज्ञानिकों के द्वारा किये गये परिणामों को नहीं समझा सका।
प्रश्न 3.
रदरफोर्ड के परमाणु मॉडल की क्या सीमाएँ हैं?
उत्तर:
मैक्सवेल के विद्युत चुम्बकीय सिद्धान्त के अनुसार रदरफोर्ड का परमाणु मॉडल दोषपूर्ण पाया गया। इस सिद्धान्त के अनुसार गति करता हुआ विद्युत आवेशित कण निरन्तर विद्युत चुम्बकीय तरंगें विकरित करेगा, जिससे उसकी ऊर्जा में कमी होगी। अतः ऊर्जा में इस प्रकार की कमी होने
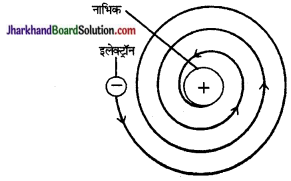
के कारण इलेक्ट्रॉन की गति कम होती जायेगी, जिससे उसकी कक्षाएँ छोटी होती जायेंगी और अन्त में इलेक्ट्रॉन नाभिक में गिर जायेगा (चित्र)। इसका अभिप्राय यह होगा कि परमाणु एक अस्थायी यन्त्र है। इसका समाधान रदरफोर्ड के मॉडल द्वारा नहीं किया जा सका।
प्रश्न 4.
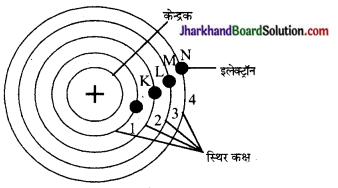
बोर के परमाणु मॉडल की व्याख्या कीजिए।
उत्तर:
रदरफोर्ड के परमाणु मॉडल की कमियों को दूर करने के लिए बोर ने सन् 1931 में क्वाण्टम सिद्धान्त पर आधारित नया परमाणु मॉडल प्रस्तुत किया। इसके अनुसार-
- परमाणु में इलेक्ट्रॉन नाभिक के चारों ओर निश्चित एवं स्थायी वृत्ताकार कक्षाओं में चक्कर लगाते हैं।
- प्रत्येक कक्षा में चक्कर लगाने वाले इलेक्ट्रॉन की ऊर्जा निश्चित होती है। इन कक्षाओं को ऊर्जा स्तर (Energy Levels) भी कहते हैं।
- इन कक्षाओं में चक्रण करता हुआ इलेक्ट्रॉन न तो ऊर्जा का अवशोषण करता है और न उत्सर्जन।
- ऊर्जा का अवशोषण करने पर इलेक्ट्रॉन निम्न ऊर्जा स्तर से उच्च ऊर्जा स्तर में तथा ऊर्जा का उत्सर्जन करने पर इलेक्ट्रॉन उच्च ऊर्जा से निम्न ऊर्जा स्तर में संक्रमित हो जाता है। इन कक्षाओं को 1, 2, 3, 4 या K, L, M, N से प्रदर्शित करते हैं।
प्रश्न 5.
इस अध्याय में दिए गए सभी परमाणु मॉडलों की तुलना कीजिए।
उत्तर:
| टॉमसन का परमाणु मॉडल | रदरफोर्ड का परमाणु मॉडल | बोर का परमाणु मॉडल | |
| (a) धन आवेश (प्रोटॉन) | परमाणु के अन्दर धनावेशित क्षेत्र होता है। | धनावेश परमाणु के केन्द्र में इकट्ठा होता है। यह भारी, धनावेशित केन्द्र नाभिक कहलाता है। | धनावेश परमाणु के केन्द्र में स्थित नाभिक में इकट्ठा होता है। |
| (b) ऋण आवेश (इलेक्ट्रॉन) | परमाणु के धनावेशित क्षेत्र में इलेक्ट्रॉन यहाँ-वहाँ बिखरे होते हैं। | नाभिक को इलेक्ट्रॉन घेरे रहते हैं। नाभिक और इलेक्ट्रॉन, स्थिर वैद्युत आकर्षण बल द्वारा अपनी-अपनी जगह टिके होते हैं। | इलेक्ट्रॉन, नाभिक के आस-पास घूमते हैं। प्रत्येक की कक्षा एवं ऊर्जा स्तर भी होता है। |
प्रश्न 6.
पहले अठारह तत्वों के विभिन्न कक्षों में इलेक्ट्रॉन वितरण के नियम को लिखिए।
उत्तर:
इलेक्ट्रॉन वितरण का बोर एवं बरी नियम निम्नलिखित हैं-
(1) किसी कक्ष में अधिकतम इलेक्ट्रॉनों की संख्या 2n² हो सकती है। जबकि n इलेक्ट्रॉन की कक्ष संख्या है।
प्रथम कक्ष में इलेक्ट्रॉन = 2n² = 2 x (1)² = 2
द्वितीय कक्ष में इलेक्ट्रॉन = 2 x (2)² = 2 x 4 = 8
तृतीय कक्ष में इलेक्ट्रॉन = 2 × (3)² = 2 × 9 = 18
(2) बाह्यतम कक्षा में अधिकतम 8 इलेक्ट्रॉन हो सकते हैं। और उससे पहले वाले कक्ष में आधे।
(3) किसी परमाणु के दिए गए कोश में इलेक्ट्रॉन तब तक स्थान नहीं लेते हैं। जब तक कि उससे पहले वाले भीतरी कक्ष पूर्ण रूप से भर नहीं जाते। स्पष्ट होता है कि कक्षाएँ क्रमानुसार भरती हैं।
प्रश्न 7.
सिलिकॉन और ऑक्सीजन का उदाहरण लेते हुए संयोजकता की परिभाषा दीजिए।
उत्तर:
कोई परमाणु बाह्यतम कोश को पूर्ण करने के लिए जितने इलेक्ट्रॉन लेता है या देता है, वही उसकी संयोजकता कहलाती है।
क्योंकि यह दो इलेक्ट्रॉन ग्रहण कर सकता है।

क्योंकि यह दो इलेक्ट्रॉन ग्रहण कर सकता है।
प्रश्न 8.
उदाहरण के साथ व्याख्या कीजिए-परमाणु संख्या, द्रव्यमान संख्या, समस्थानिक और समभारिक समस्थानिकों के कोई दो उपयोग लिखिए।
उत्तर:
परमाणु संख्या-किसी तत्व के परमाणु के नाभिक में उपस्थित प्रोटॉन की संख्या को उसकी परमाणु संख्या कहते हैं। जैसे-हाइड्रोजन की परमाणु संख्या 1 क्योंकि इसके नाभिक में 1 प्रोटॉन होता है। कार्बन की परमाणु संख्या 6 है क्योंकि इसके नाभिक में 6 प्रोटॉन होते हैं।
द्रव्यमान संख्या-किसी तत्व के नाभिक में उपस्थित प्रोटॉन और न्यूट्रॉन की कुल संख्या द्रव्यमान संख्या कहलाती है। जैसे-कार्बन की द्रव्यमान संख्या 12 है क्योंकि कार्बन के नाभिक में 6 प्रोटॉन और 6 न्यूट्रॉन होते हैं। ऐलुमिनियम की द्रव्यमान संख्या 27 है क्योंकि इसके नाभिक में 13 प्रोटॉन और 14 न्यूट्रॉन होते हैं।
समस्थानिक- किसी तत्व के ऐसे परमाणु जिनकी परमाणु संख्या समान होती है किन्तु द्रव्यमान संख्या भिन्न-भिन्न होती है वे उस तत्व के समस्थानिक कहलाते हैं। जैसे-
क्लोरीन के दो समस्थानिक हैं।
क्लोरीन \({ }_{17}^{35} \mathrm{Cl}\)
क्लोरीन \({ }_{17}^{37} \mathrm{Cl}\)
समभारिक – तत्वों के ऐसे परमाणु जिनकी द्रव्यमान संख्या समान होती है किन्तु परमाणु संख्या भिन्न-भिन्न होती है, समभारिक कहलाते हैं जैसे कैल्शियम की परमाणु संख्या 20 तथा आर्गन की परमाणु
संख्या 18 है परन्तु दोनों के परमाणु द्रव्यमान समान (40) हैं।
समस्थानिकों के उपयोग:
- कैंसर के उपचार में कोबाल्ट के समस्थानिक (Co-60) का प्रयोग किया जाता है।
- घेंघा रोग के उपचार में 1-131 समस्थानिक का प्रयोग किया जाता है।
![]()
प्रश्न 9.
Na के पूरी तरह से भरे हुए K व L कोश होते हैं- व्याख्या कीजिए।
उत्तर:
सोडियम (Na) का परमाणु क्रमांक 11 है; अतः इसका इलेक्ट्रॉनिक विन्यास 2, 8, 1 है। M-कोश के इलेक्ट्रॉन निकल जाने के उपरान्त सोडियम आयन (Na+) प्राप्त होता है जिसके K कोश में 2 तथा L कोश में 8 इलेक्ट्रॉन होते हैं तथा M- कोश विलुप्त हो जाता है। शेष दोनों कोशों में इलेक्ट्रॉनों की संख्या, इन कोशों में होने वाले इलेक्ट्रॉनों की अधिकतम संख्या के बराबर है अर्थात् K तथा L कोश पूर्णतः भरे हुए हैं।
प्रश्न 10.
अगर ब्रोमीन परमाणु दो समस्थानिकों [ \({ }_{35} \mathbf{B r}^{79}\) (49.7%) तथा \({ }_{35} \mathrm{B} r^{81}\) (50.3%)] के रूप में है तो ब्रोमीन परमाणु के औसत परमाणु द्रव्यमान की गणना कीजिए ।
हल:
ब्रोमीन परमाणु का औसत परमाणु द्रव्यमान
= \(\left(79 \times \frac{49.7}{100}+81 \times \frac{50.3}{100}\right)\)
= 39.263 + 40.743
= 80.006 u
प्रश्न 11.
एक तत्त्व का परमाणु द्रव्यमान 16.2u है तो इसके किसी एक नमूने में समस्थानिक \({ }_8 X^{16}\) और \({ }_8 X^{18}\) का प्रतिशत क्या होगा?
है।
होगी।
उत्तर:
माना नमूने में \({ }_8 X^{16}\) समस्थानिक की प्रतिशतता a है।
अत: \({ }_8 X^{18}\) समस्थानिक की प्रतिशतता (100-a)
अब

अतः नमूने में, \({ }_8 \mathrm{X}^{16}\) की प्रतिशतता 90% तथा \({ }_8 \mathrm{X}^{16}\) की
प्रतिशतता 10% होगीं।
प्रश्न 12.
यदि तत्व का Z = 3 हो तो तत्व की संयोजकता क्या होगी? तत्व का नाम भी लिखिए।
उत्तर:
Z = 3 वाले तत्व का इलेक्ट्रॉनिक विन्यास 2, 1 होगा अर्थात् स्थायी विन्यास प्राप्त करने के लिए यह अपने बाह्यतम कोश में स्थित एक इलेक्ट्रॉन को त्याग सकता है। अतः इसकी संयोजकता 1 होगी तत्व का नाम लीथियम (Li) है।
प्रश्न 13.
दो परमाणु स्पीशीज के केन्द्रकों का संघटन नीचे दिया गया है-
| X | Y | |
| प्रोटॉन | 6 | 6 |
| न्यूट्रॉन | 6 | 8 |
X और Y की द्रव्यमान संख्या ज्ञात कीजिए। इन दोनों स्पीशीज में क्या सम्बन्ध है?
उत्तर:
द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
X की द्रव्यमान संख्या = 6 + 6 + 12
Y की द्रव्यमान संख्या = 6 + 8 = 14
X का परमाणु क्रमांक 6 = Y का परमाणु क्रमांक चूँकि दोनों परमाणु स्पीशीज की परमाणु संख्या समान तथा द्रव्यमान संख्या भिन्न-भिन्न है; अतः ये समस्थानिक होंगे। X तथा Y दोनों कार्बन के समस्थानिक \({ }_6 \mathrm{C}^{12}\) तथा \({ }_6 \mathrm{C}^{14}\) हैं।
प्रश्न 14.
निम्नलिखित वक्तव्यों में गलत के लिए- F और सही के लिए T लिखें।
(a) जे. जे. टामसन ने यह प्रस्तावित किया था कि परमाणु के केन्द्रक में केवल न्यूक्लीयॉन्स होते हैं।
(b) एक इलेक्ट्रॉन और प्रोटॉन मिलकर न्यूट्रॉन का निर्माण करते हैं, इसलिए यह अनावेशित होता है।
(c) इलेक्ट्रॉन का द्रव्यमान प्रोटॉन से लगभग \(\frac { 1 }{ 2000 }\) गुणा होता है।
(d) आयोडीन के समस्थानिक का इस्तेमाल टिंक्चर आयोडीन बनाने में होता है। इसका उपयोग दवा के रूप में होता है।
उत्तर:
(a) F
(b) F
(c) T
(d) F
प्रश्न संख्या 15, 16 और 17 में सही के सामने (✓) का चिह्न और गलत के सामने (x) का चिह्न लगाइए।
प्रश्न 15.
रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग किसकी खोज के लिए उत्तरदायी था ?
(a) परमाणु केन्द्रक
(b) इलेक्ट्रॉन
(c) प्रोटॉन
(d) न्यूट्रॉन।
उत्तर:
(a) (✓)
(b) (✗)
(c) (✗)
(d) (✗)।
प्रश्न 16.
एक तत्व के समस्थानिक में होते हैं-
(a) समान भौतिक गुण
(b) भिन्न रासायनिक गुण
(c) न्यूट्रॉनों की अलग-अलग संख्या
(d) भिन्न परमाणु संख्या ।
उत्तर:
(a) (✗)
(b) (✗)
(c) (✓)
(d) (✗)।
प्रश्न 17.
Cl– आयन में संयोजकता- इलेक्ट्रॉनों की संख्या है-
(a) 16
(b) 8
(c) 17
(d) 18
उत्तर:
(a) (✗)
(b) (✓)
(c) (✗)
(d) (✗)।
प्रश्न 18.
सोडियम का सही इलेक्ट्रॉनिक विन्यास निम्न में कौन सा है?
(a) 2,8
(b) 8, 2, 1
(c) 2, 1, 8
(d) 2, 8, 1
उत्तर:
(d) 2, 8, 1.
प्रश्न 19.
निम्नलिखित सारणी को पूरा कीजिए-
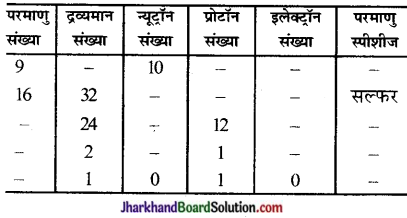
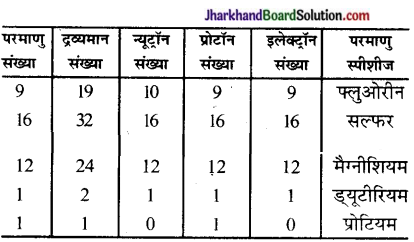
उत्तर:
Jharkhand Board Class 9 Science परमाणु की संरचना InText Questions and Answers
क्रियाकलाप 1.
(A) सूखे बालों पर कंघी करने के बाद क्या कंघी कागज के छोटे-छोटे टुकड़ों को आकर्षित करती है?
(B) काँच की एक छड़ को रेशम के कपड़े पर रगड़कर इस छड़ को हवा से भरे गुब्बारे के पास लाइए और होने वाले परिणामों को देखिए।
निष्कर्ष-
(A) सूखे बालों पर कंत्री करने से कंघी आवेशित हो जाती है जिससे कागज के छोटे-छोटे टुकड़े उससे चिपक जाते हैं।
(B) काँच की एक छड़ को रेशम के कपड़े पर रगड़ने से छड़ आवेशित हो जाती है जब हम इस छड़ को हवा से भरे गुब्बारे के पास लाते हैं तो हवा से भरा गुब्बारा छड़ के साथ चिपक जाता है।
इससे यह पता चला कि परमाणु विभाज्य है और आवेशित कणों से मिलकर बना है। परमाणु में उपस्थित आवेशित कर्णों का पता लगाने में कई वैज्ञानिकों ने योगदान दिया। जे. जे. टॉमसन ने बताया कि परमाणु में एक अवपरमाणुक कण इलेक्ट्रॉन विद्यमान होता है। गोल्डस्टीन ने 1886 में एक नए विकिरण की खोज की जिसका नाम कैनाल किरणें रखा। ये किरणें धनावेशित विकिरण थीं, जिसके द्वारा अन्य अवपरमाणुक कणों की खोज हुई। नए कण का द्रव्यमान इलेक्ट्रॉन के द्रव्यमान का लगभग 2000 गुना अधिक होता है, इसे प्रोटॉन नाम दिया गया। इलेक्ट्रॉन को द्वारा तथा प्रोटॉन को द्वारा दर्शाया जाता है। प्रोटॉन का द्रव्यमान 1 इकाई तथा आवेश +1 लिया जाता है। इलेक्ट्रॉन का द्रव्यमान नगण्य और आवेश 1 माना जाता है।
ऐसा माना गया कि परमाणु प्रोटॉन और इलेक्ट्रॉन से बने होते हैं तो परस्पर आवेशों को संतुलित करते हैं। यह भी प्रतीत हुआ कि प्रोटॉन परमाणु के सबसे भीतरी भाग में होते हैं। इलेक्ट्रॉन को आसानी से निकाला जा सकता है लेकिन प्रोटॉनों को नहीं।
खंड 4.1 से सम्बन्धित पाठ्य पुस्तक के प्रश्नोत्तर (पा.पु. पू. सं. – 53 )
प्रश्न 1.
कैनाल किरणें क्या हैं?
उत्तर:
र- इलेक्ट्रॉन के सम्बन्ध में जानकारी प्राप्त होने के पहले, ई. गोल्डस्टीन ने 1886 में एक नए विकिरण की खोज की, जिसे उन्होंने ‘कैनाल किरणें नाम दिया। ये किरणें धनावेशित विकिरण थीं, जिसके द्वारा अन्तत: दूसरे अवपरमाणुक कण की खोज हुई।
![]()
प्रश्न 2.
यदि किसी परमाणु में एक इलेक्ट्रॉन और एक प्रोटॉन है, तो इसमें कोई आवेश होगा या नहीं?
उत्तर:
चूँकि एक इलेक्ट्रान और एक प्रोटॉन पर आवेश बराबर होता है, इसलिए एक इलेक्ट्रॉन और एक प्रोटॉन पर आवेश नहीं होगा। दूसरे शब्दों में यह एक उदासीन परमाणु वाली स्थिति है।
खंड 4.2 से सम्बन्धित पाठ्य पुस्तक के प्रश्नोत्तर (पा. पु. पू. सं. – 56)
प्रश्न 1.
परमाणु उदासीन है, इस तथ्य को टॉमसन के मॉडल के आधार पर स्पष्ट कीजिए।
उत्तर:
- टॉमसन के मॉडल के अनुसार परमाणु एक धनात्मक क्षेत्र से बना है, जिसमें ऋणात्मक कण अर्थात् इलेक्ट्रॉन इधर-उधर बिखरे हैं।
- परमाणु के धनात्मक तथा ऋणात्मक आवेश एक-दूसरे को सन्तुलित कर देते हैं। इसलिए परमाणु उदासीन होता है।
प्रश्न 2.
रदरफोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में कौन-सा अवपरमाणुक कण विद्यमान है?
उत्तर:
परमाणु के नाभिक में धनावेशित कण (प्रोटॉन) होता है।
प्रश्न 3.
तीन कक्षाओं वाले बोर परमाणु मॉडल का चित्र बनाइए।
उत्तर:
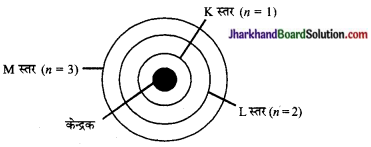
प्रश्न 4.
क्या अल्फा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से सम्भव होगा ?
उत्तर:
सोने की अत्यन्त महीन पन्नी ( लगभग 1000 परमाणुओं के बराबर मोटी) प्राप्त करना सम्भव होता है, जो प्रकीर्णन प्रयोग के लिए आवश्यक है। किसी अन्य धातु की इतनी महीन पन्नी प्राप्त करना सम्भव नहीं है। अतः प्रकीर्णन प्रयोग में सोने के अतिरिक्त किसी अन्य धातु की पन्नी का प्रयोग सम्भव नहीं है।
खंड 4.2.4 से सम्बन्धित पाठ्य पुस्तक के प्रश्नोत्तर (पा. पु. पृ. सं.-56)
प्रश्न 1.
परमाणु के तीन अवपरमाणुक कणों के नाम लिखिए।
उत्तर:
परमाणु के तीन अवपरमाणुक कण इलेक्ट्रॉन, प्रोटॉन तथा न्यूट्रॉन हैं।
प्रश्न 2.
हीलियम परमाणु का परमाणु द्रव्यमान 4u है और उसके नाभिक में दो प्रोटॉन होते हैं। इसमें कितने न्यूट्रॉन होंगे?
उत्तर:
न्यूट्रॉनों की संख्या = परमाणु द्रव्यमान – प्रोटॉनों की संख्या
= 4 – 2 = 2
खण्ड 4. 3 से सम्बन्धित पाठ्य पुस्तक के प्रश्नोत्तर (पा. पु. पृ. सं. -57)
प्रश्न 1.
कार्बन तथा सोडियम के परमाणुओं के लिए इलेक्ट्रॉन वितरण लिखिए।
उत्तर:
कार्बन का परमाणु क्रमांक = 6
इलेक्ट्रॉन वितरण = 2, 4
सोडियम का परमाणु क्रमांक = 11
इलेक्ट्रॉन वितरण = 2, 8, 1
प्रश्न 2.
अगर किसी परमाणु का K और L कोश भरा है तो उस परमाणु में इलेक्ट्रॉनों की संख्या क्या होगी ?
उत्तर:
K कोश (n = 1) में इलेक्ट्रॉनों की अधिकतम संख्या = 2 (1)2 = 2
L कोश (n = 2) में इलेक्ट्रॉनों की अधिकतम संख्या = 2 (2)2 = 8
अत: परमाणु में 2 + 8 = 10 इलेक्ट्रॉन होंगे
खण्ड 4.4 से सम्बन्धित पाठ्य पुस्तक के प्रश्नोत्तर (पा. प. प. सं. -58)
प्रश्न 1.
क्लोरीन, सल्फर और मैग्नीशियम की परमाणु संख्या से आप इनकी संयोजकता कैसे प्राप्त करेंगे ?
उत्तर:
क्लोरीन (Z = 17 ) – इसका इलेक्ट्रॉनिक विन्यास 2, 8, 7 है। स्पष्ट है कि क्लोरीन परमाणु को अपना अष्टक अर्थात् बाह्यतम कोश को पूर्ण भरने के लिए केवल एक इलेक्ट्रॉन की आवश्यकता होती है; अतः इसकी संयोजकता है।
सल्फर (Z = 16 ) – इसका इलेक्ट्रॉनिक विन्यास 2, 8.6 है। स्पष्ट है कि सल्फर परमाणु को अपना बाह्यतम कोश पूर्ण करने के लिए 2 इलेक्ट्रॉनों की आवश्यकता होती है; अतः इसकी संयोजकता 2 है।
मैग्नीशियम (Z = 12 ) – इसका इलेक्ट्रॉनिक विन्यास 2, 8, 2 है। स्पष्ट है कि मैग्नीशियम परमाणु के बाह्यतम कोश में 2 इलेक्ट्रॉन हैं तथा स्थायी विन्यास प्राप्त करने के लिए यह इन इलेक्ट्रॉनों को त्याग सकता है। अतः इसकी संयोजकता 2 है।
खण्ड 4.5 से सम्बन्धित पाठ्य पुस्तक के प्रश्नोत्तर (पा. प. प. सं. -59)
प्रश्न 1.
यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है तब,
(a) परमाणु की परमाणुक संख्या क्या है?
(b) परमाणु का क्या आवेश है?
उत्तर:
(a) परमाणु की परमाणु संख्या परमाणु के नाभिक में उपस्थित प्रोटॉनों की संख्या = 8
(b) चूँकि परमाणुक में इलेक्ट्रॉनों तथा प्रोटॉनों की संख्या समान है; अत: इस पर कोई आवेश नहीं होगा अर्थात् परमाणु विद्युत उदासीन होगा।
प्रश्न 2.
सारणी 4.3 की सहायता से ऑक्सीजन और सल्फर परमाणु की द्रव्यमान संख्या ज्ञात कीजिए।
उत्तर:
सारणी 4.3 के अनुसार
ऑक्सीजन परमाणु में प्रोटॉनों की संख्या = 8
तथा ऑक्सीजन परमाणु में न्यूट्रॉनों की संख्या = 8
अब द्रव्यमान संख्या प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
द्रव्यमान संख्या = 8 + 8 =16
सल्फर परमाणु में प्रोटॉनों की संख्या = 16
तथा सल्फर परमाणु में न्यूट्रॉनों की संख्या = 16
अतः द्रव्यमान संख्या 16 + 16 = 32
खण्ड 4.6 से सम्बन्धित पाठ्य पुस्तक के प्रश्नोत्तर (पा. प. प. सं. -60)
प्रश्न 1.
समस्थानिक और समभारिक के किसी एक युग्म का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
समस्थानिक – 6C12 तथा 6C14
इलेक्ट्रॉनिक विन्यास = 2, 4
समभारिक – 20C40 तथा 18A40
इलेक्ट्रॉनिक विन्यास, 20Ca40 : 2, 8, 8, 2
इलेक्ट्रॉनिक विन्यास 18A40 : 2, 8, 8
![]()
प्रश्न 2.
चिह्न H, D और T के लिए प्रत्येक में पाए जाने वाले तीन अवपरमाणुक कणों को सारणीबद्ध कीजिए।
उत्तर:
| समस्थानिक | तीन अवपरमाणुक कण | ||
| इलेक्ट्रॉन | प्रोटॉन | न्यूट्रॉन | |
| H | 1 | 1 | 0 |
| D | 1 | 1 | 1 |
| T | 1 | 1 | 2 |