Jharkhand Board JAC Class 10 Science Solutions Chapter 3 धातु एवं अधातु Textbook Exercise Questions and Answers.
JAC Board Class 10 Science Solutions Chapter 3 धातु एवं अधातु
Jharkhand Board Class 10 Science धातु एवं अधातु Textbook Questions and Answers
प्रश्न 1.
निम्न में कौन-सा युगल विस्थापन अभिक्रिया प्रदर्शित करता है-
(a) NaCl विलयन एवं कॉपर धातु
(b) MgCl2 विलयन एवं ऐलुमिनियम धातु
(c) FeSO4 विलयन एवं सिल्वर धातु
(d) AgNO3 विलयन एवं कॉपर धातु
उत्तर:
(d) AgNO3 विलयन एवं कॉपर धातु।
प्रश्न 2.
लोहे के फ्राइंग पैन (frying pan) को जंग से बचाने के लिए निम्न में से कौन-सी विधि उपयुक्त है?
(a) ग्रीज लगाकर
(b) पेंट लगाकर
(c) जिंक की परत चढ़ाकर
(d) ये सभी
उत्तर:
(c) जिंक की परत चढ़ाकर।
प्रश्न 3.
कोई धातु ऑक्सीजन के साथ अभिक्रिया कर उच्च गलनांक वाला यौगिक निर्मित करती है यह यौगिक जल में विलेय है। यह तत्त्व क्या हो सकता है?
(a) कैल्सियम
(b) कार्बन
(c) सिलिकन
(d) लोहा
उत्तर:
(a) कैल्सियम
![]()
प्रश्न 4.
खाद्य पदार्थ के डिब्बों पर जिंक की बजाय टिन की परत होती है क्योंकि-
(a) टिन की अपेक्षा जिंक मँहगा है।
(b) टिन की अपेक्षा जिंक का गलनांक अधिक है
(c) टिन की अपेक्षा जिंक अधिक अभिक्रियाशील है
(d) टिन की अपेक्षा जिंक कम अभिक्रियाशील है
उत्तर:
(c) टिन की अपेक्षा जिंक अधिक अभि-क्रियाशील है।
प्रश्न 5.
आपको एक हथौड़ा, बैटरी, बल्ब, तार एवं स्विच दिया गया है-
(a) इनका उपयोग कर धातुओं एवं अधातुओं के नमूनों को कैसे अलग कर सकते हैं?
(b) धातुओं एवं अधातुओं में विभेदन के लिए इन परीक्षणों की उपयोगिताओं का आकलन कीजिए।
उत्तर:
(a) नीचे दिए गए चित्र के अनुरूप हम एक परिपथ बनाएँगे।
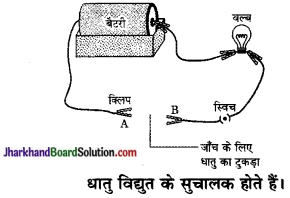
यदि नमूने को विद्युत परिपथ में लगाने पर स्विच ऑन करने पर बल्ब जलता है, तो दिया गया नमूना एक धातु है।
(b) यह विधि धातु एवं अधातु की जाँच के लिए बहुत ही उपयोगी है, किन्तु ग्रेफाइट एक अपवाद है क्योंकि यह अधातु होते हुए भी विद्युत का चालक है।
प्रश्न 6.
उभयधर्मी ऑक्साइड क्या होते हैं? दो उभयधर्मी ऑक्साइडों का उदाहरण दीजिए।
उत्तर:
वे ऑक्साइड जो अम्ल तथा क्षार दोनों से अभिक्रिया कर लवण प्रदान करते हैं, उभयधर्मी ऑक्साइड कहलाते हैं। उदाहरण के लिए ऐलुमिनियम ऑक्साइड निम्नलिखित तरीके से अम्लों तथा क्षारों के साथ अभिक्रिया करता है
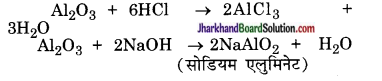
जिंक ऑक्साइड एक अन्य उभयधर्मी ऑक्साइड है।
प्रश्न 7.
दो धातुओं के नाम बताइए जो तनु अम्ल से हाइड्रोजन को विस्थापित कर देंगे तथा दो धातुएँ जो ऐसा नहीं कर सकती हैं।
उत्तर:
हाइड्रोजन को विस्थापित करने वाली धातुएँ – मैग्नीशियम, जिंक हाइड्रोजन को विस्थापित नहीं कर सकने वाली धातुएँ – कॉपर, सोना।
प्रश्न 8.
किसी धातु M के विद्युत अपघटनी परिष्करण में आप ऐनोड, कैथोड एवं विद्युत अपघट्य किसे बनाएँगे?
उत्तर:
इस प्रक्रिया में अशुद्ध धातु को ऐनोड बनाया जाता है तथा शुद्ध धातु की एक पतली पट्टी को कैथोड बनाया जाता है। धात्विक लवण का उपयोग विद्युत अपघट्य के रूप में किया जाता है। उपकरणों को दिए गए चित्र के अनुसार व्यवस्थित किया जाता है। विद्युत अपघट्य से विद्युत प्रवाहित करने पर ऐनोड पर स्थित शुद्ध
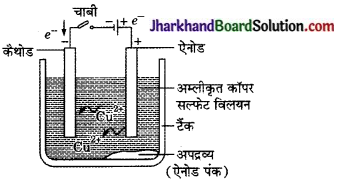
ताँबे का विद्युत अपघटनी परिष्करण अम्लीकृत कॉपर सल्फेट का विलयन विद्युत अपघट्य है। अशुद्ध ताँबा ऐनोड है जबकि शुद्ध ताँबे की पट्टी कैथोड का कार्य करती है। विद्युत धारा प्रवाहित करने पर शुद्ध ताँबा कैथोड पर निक्षेपित हो जाता है।
धातु विद्युत अपघट्य में घुल जाता है। शुद्ध धातु की इतनी ही मात्रा कैथोड पर जमा हो जाती है। विलयशील अशुद्धियाँ विलयन में पहुँच जाती हैं जबकि अविलयशील अशुद्धियाँ ऐनोड के नीचे जम जाती हैं, जिन्हें ऐनोड पंक कहा जाता है।
प्रश्न 9.
प्रत्यूष ने सल्फर चूर्ण को स्पैचुला में लेकर उसे गर्म किया। चित्र के अनुसार एक परखनली को उल्टा करके उसने उत्सर्जित गैस को एकत्र किया।
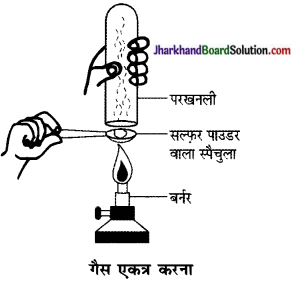
(a) गैस की क्रिया क्या होगी
(i) सूखे लिटमस पत्र पर?
(ii) आर्द्र लिटमस पत्र पर?
(b) ऊपर की अभिक्रियाओं के लिए संतुलित रासायनिक अभिक्रिया लिखिए।
उत्तर:
(a) (i) सूखे लिटमस पत्र पर कोई क्रिया नहीं होती।
(ii) यह गैस आर्द्र नीले लिटमस पत्र को लाल कर देती है।
(b) S + O2 → SO2
प्रश्न 10.
लोहे को जंग से बचाने के लिए दो तरीके बताइए।
उत्तर:
- यशदलेपन – इस प्रक्रिया में लोहे की वस्तुओं के ऊपर जिंक की एक परत चढ़ाई जाती है।
- पेंटिंग – इस प्रक्रिया में लोहे की वस्तुओं पर पेंट किया जाता है।
![]()
प्रश्न 11.
ऑक्सीजन के साथ संयुक्त होकर अधातुएँ कैसा ऑक्साइड बनाती हैं?
उत्तर:
क्षारीय तथा उभयधर्मी ऑक्साइड।
प्रश्न 12.
कारण बताइए-
(a) प्लैटिनम, सोना एवं चाँदी का उपयोग आभूषण बनाने के लिए किया जाता है।
(b) सोडियम, पोटैशियम एवं लीथियम को तेल के अंदर संगृहीत किया जाता है।
(c) ऐलुमिनियम अत्यधिक अभिक्रियाशील धातु है। फिर भी इसका उपयोग खाना बनाने वाले बर्तन बनाने के लिए किया जाता है।
(d) निष्कर्षण प्रक्रम में कार्बोनेट एवं सल्फाइड अयस्क को ऑक्साइड में परिवर्तित किया जाता है।
उत्तर:
(a) प्लैटिनम, सोना एवं चाँदी बहुत कम अभिक्रियाशील हैं तथा संक्षारित भी नहीं होते। उनकी चमक भी तेज होती है। इन्हीं कारणों से इनका उपयोग आभूषण बनाने के लिए किया जाता है।
(b) सोडियम एवं पोटैशियम जैसी धातुएँ इतनी अभिक्रियाशील हैं कि खुले में रखने पर तत्काल आग पकड़ लेती हैं। अर्थात् उन्हें बचाने तथा आग लगने से रोकने के लिए उन्हें किरोसीन तेल के अंदर संगृहीत किया जाता है।
(c) ऐलुमिनियम संक्षारित नहीं होता, साथ ही यह ऊष्मा का सुचालक है।
(d) किसी धातु को उसके सल्फाइड और कार्बोनेट की अपेक्षा उसके ऑक्साइड से प्राप्त करना अधिक आसान है। इसलिए अपचयन से पहले धातु सल्फाइड एवं कार्बोनेट को धातु ऑक्साइड में बदल लेना चाहिए।
प्रश्न 13.
आपने ताँबे के मलीन बर्तन को नींबू या इमली के रस से साफ करते अवश्य देखा होगा। यह खट्टे पदार्थ बर्तन को साफ करने में क्यों प्रभावी हैं?
उत्तर:
ताँबे के ऊपर आर्द्र वायु तथा CO2 के कारण कॉपर कार्बोनेट की एक हरी-सी परत बन जाती है, जो क्षारकीय प्रकृति की होती है। इसलिए जब इसे नींबू या इमली के रस से साफ करते हैं, तो इसमें मौजूद अम्ल क्षारक को उदासीन कर देता है और बर्तन साफ हो जाता है।
कॉपर कार्बोनेट + साइट्रिक अम्ल → कॉपर साइट्रेट + CO2 + H2O
प्रश्न 14.
रासायनिक गुणधर्मों के आधार पर धातुओं एवं अधातुओं में विभेद कीजिए।
उत्तर:
धातुओं एवं अधातुओं में निम्न प्रकार से विभेद किया जा सकता है-
| धातु | अधातु |
| 1. धातुएँ क्षारकीय ऑक्साइड बनाती हैं। | 1. अधातुएँ अम्लीय या उदासीन ऑक्साइड बनाती हैं। |
| 2. धातुएँ तनु HCl या तनु H2SO4 से अभिक्रिया कर H2 गैस मुक्त करती हैं, क्योंकि हाइड्रोजन को विस्थापित कर देती हैं। | 2. अधातुएँ तनु HCl या तनु H2SO4 से अभिक्रिया नहीं करती हैं क्योंक हाइड्रोजन को विस्थापित नहीं करती हैं। |
| 3. धातुएँ अपचायक होती हैं। | 3. अधातुएँ उपचायक होती हैं। |
| 4. धातुएँ इलेक्ट्रॉन त्यागकर धनात्मक आयन बनाती हैं। | 4. अधातुएँ इलेक्ट्रॉन ग्रहण कर ऋणात्मक आयन बनाती है। |
| 5. धातुएँ जल (या भाप) से हाइड्रोजन को विस्थापित कर देती हैं। | 5. अधातुएँ जल से या भाप से अभिक्रिया नहीं करती हैं। अतः हाइड्रोजन को जल से विस्थापित नहीं करती हैं। |
| 6. सभी धातुएँ H2 से संयोग कर हाइड्राइड नहीं बनाती हैं (केवल Na, K, Ca जैसे क्रियाशील तत्त्व बनाती हैं)। | 6. सभी अधातुएँ H2 से संयोग कर हाइड्राइड बनाती हैं। |
प्रश्न 15.
एक व्यक्ति प्रत्येक घर में सुनार बनकर जाता है। उसने पुराने एवं मलीन सोने के आभूषणों में पहले जैसी चमक पैदा करने का ढोंग रचाया। कोई संदेह किये बिना ही एक महिला अपने सोने के कंगन उसे देती है जिसे वह एक विशेष विलयन में डाल देता है। कंगन नए की तरह चमकने लगते हैं लेकिन उनका वजन अत्यन्त कम हो जाता है। वह महिला बहुत दुखी होती है तथा तर्क-वितर्क के पश्चात् उस व्यक्ति को झुकना पड़ता है। एक जासूस की तरह क्या आप उस विलयन की प्रकृति के बारे में बता सकते हैं?
उत्तर:
उस सुनार द्वारा ऐक्वारेजिया विलयन का उपयोग किया गया।
प्रश्न 16.
गर्म जल का टैंक बनाने में ताँबे का उपयोग होता है परंतु इस्पात (लोहे की मिश्रधातु) का नहीं। इसका कारण बताइए।
उत्तर:
गर्म लोहा उबलते पानी से उत्पन्न भाप के साथ अभिक्रिया करता है, किंतु ताँबा जल के साथ अभिक्रिया नहीं करता है।
Jharkhand Board Class 10 Science धातु एवं अधातु InText Questions and Answers
पाठगत प्रश्न (पृष्ठ संख्या-45)
प्रश्न 1.
ऐसी धातु का उदाहरण दीजिए जो-
(i) कमरे के ताप पर द्रव होती है।
(ii) चाकू से आसानी से काटा जा सकता है।
(iii) ऊष्मा की सबसे अच्छी चालक होती है।
(iv) ऊष्मा की कुचालक होती है।
उत्तर:
(i) मर्करी (Hg)।
(ii) सोडियम (Na) लीथियम (Li) और पोटैशियम (K)।
(iii) सिल्वर (Ag) तथा कॉपर (Cu)।
(iv) लेड (Pb) तथा मर्करी (Hg )।
प्रश्न 2.
आघातवर्ध्य तथा तन्य का अर्थ बताइए।
उत्तर:
कुछ धातुओं को पीटकर पतली चादर बनाया जा सकता है। इस गुणधर्म को आघातवर्ध्यता कहते हैं। सोना तथा चाँदी सबसे अधिक आघातवर्ध्य धातुएँ हैं। धातु के पतले तार के रूप में खींचने की क्षमता को तन्यता कहा जाता है। सोना सबसे अधिक तन्य धातु है।
पाठगत प्रश्न (पृष्ठ संख्या – 51)
प्रश्न 1.
सोडियम को किरोसीन तेल में डुबो कर क्यों रखा जाता है?
उत्तर:
सोडियम सामान्य ताप पर भी नमी तथा ऑक्सीजन के साथ तेजी से अभिक्रिया करती है। किन्तु यह किरोसीन के साथ न तो कोई अभिक्रिया करती है और न ही इसमें घुलती है। अतः सोडियम को किरोसीन तेल में डुबो कर रखा जाता है।
प्रश्न 2.
इन अभिक्रियाओं के लिए समीकरण लिखिए:
(i) भाप के साथ आयरन।
(ii) जल के साथ कैल्सियम तथा पोटैशियम।
उत्तर:
(i) 2Fe + 3H2O → Fe2O3 + 3H2
(ii) Ca + 2H2O → Ca(OH)2 + H2
2K + 2H2O → 2KOH + H2 + ऊष्मा
प्रश्न 3.
A, B, C एवं D चार धातुओं के नमूनों को लेकर एक-एक करके निम्न विलयन में डाला गया। इससे प्राप्त परिणाम को निम्न प्रकार से सारणीबद्ध किया गया है:
| धातु | आयरन (II) सल्फेट | कॉपर (II) सल्फेट | जिंक सल्फेट | सिल्वर नाइट्रेट |
| A | कोई अभिक्रिया नहीं | विस्थापन | ||
| B | विस्थापन | कोई अभिक्रिया नहीं | ||
| C | कोई अभिक्रिया नहीं | कोई अभिक्रिया नहीं | कोई अभिक्रिया नहीं | विस्थापन |
| D | कोई अभिक्रिया नहीं | कोई अभिक्रिया नहीं | कोई अभिक्रिया नहीं | कोई अभिक्रिया नहीं |
इस सारणी का उपयोग कर धातु A, B, C एवं D के सम्बन्ध में निम्न प्रश्नों के उत्तर दीजिए:
(i) सबसे अधिक अभिक्रियाशील धातु कौन-सी है?
(ii) धातु B को कॉपर (II) सल्फेट के विलयन में डाला जाए तो क्या होगा?
(iii) धातु A, B, C एवं D को अभिक्रियाशीलता के घटते हुए क्रम में व्यवस्थित कीजिए।
उत्तर:
(i) धातु B सर्वाधिक अभिक्रियाशील धातु है।
(ii) विस्थापन अभिक्रिया घटित होगी।
(iii) धातु B > धातु A धातु C धातु D
प्रश्न 4.
अभिक्रियाशील धातु को तनु हाइड्रोक्लोरिक अम्ल में डाला जाता है तो कौन-सी गैस निकलती है? आयरन के साथ तनु H2SO4 की रासायनिक अभिक्रिया लिखिए।
उत्तर:
धातु के लवण के साथ हाइड्रोजन गैस निकलती है।
Fe + H2SO4 → FeSO4 + H2
![]()
प्रश्न 5.
जिंक को आयरन (II) सल्फेट के विलयन में डालने से क्या होता है? इसकी रासायनिक अभिक्रिया लिखिए।
उत्तर:
जिंक आयरन (II) सल्फेट विलयन से आयरन को विस्थापित कर देता है।
Zn + FeSO4 → ZnSO4 + Fe
पाठगत प्रश्न (पृष्ठ संख्या – 54)
प्रश्न 1.
(i) सोडियम, ऑक्सीजन एवं मैग्नीशियम के लिए इलेक्ट्रॉन-बिंदु संरचना लिखिए।
(ii) इलेक्ट्रॉन के स्थानांतरण के द्वारा Na20 एवं MgO का निर्माण दर्शाइए।
(iii) इन यौगिकों में कौन-से आयन उपस्थित हैं?
उत्तर:
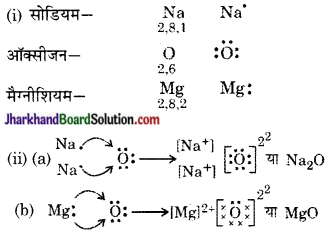
(iii) Na2O यौगिक में उपस्थित आयन-धन आयन (Na+) तथा ऋण आयन (O2-)।
MgO में उपस्थित आयन-धन आयन (Mg2+) तथा ऋण आयन (O2-)।
प्रश्न 2.
आयनिक यौगिकों का गलनांक उच्च क्यों होता है?
उत्तर:
आयनिक यौगिक ठोस एवं कठोर होते हैं। ऐसा आयनों के बीच मजबूत अन्तर- आयनिक आकर्षण बल के कारण होता है। इस आकर्षण बल को कम करने के लिए अत्यधिक मात्रा में ऊर्जा की आवश्यकता होती है। यही कारण है कि आयनिक यौगिकों का गलनांक उच्च होता है।
पाठगत प्रश्न (पृष्ठ संख्या – 59)
प्रश्न 1.
निम्न पदों की परिभाषा दीजिए- (1) खनिज, (2) अयस्क, (3) गैंग.
उत्तर:
- खनिज – वे तत्त्व या यौगिक जो भू-पर्पटी में प्राकृतिक रूप से पाए जाते हैं, उन्हें खनिज कहते हैं।
- अयस्क-कुछ स्थानों पर खनिजों में कई विशेष धातुएँ अत्यधिक मात्रा में होती हैं जिन्हें आसानी से निकाला जा सकता है। इन खनिजों को अयस्क कहते हैं।
- गैंग – पृथ्वी से प्राप्त खनिज अयस्कों में मिट्टी, रेत, आदि जैसी कई अशुद्धियाँ होती हैं जिन्हें गैंग कहा जाता है।
प्रश्न 2.
दो धातुओं के नाम बताइए जो प्रकृति में मुक्त अवस्था में पाई जाती हैं।
उत्तर:
सोना एवं प्लैटिनम।
प्रश्न 3.
धातु को उसके ऑक्साइड से प्राप्त करने के लिए किस रासायनिक प्रक्रिया का उपयोग किया जाता है?
उत्तर:
कार्बन द्वारा अपचयन की प्रक्रिया।
पाठगत प्रश्न (पृष्ठ संख्या – 61)
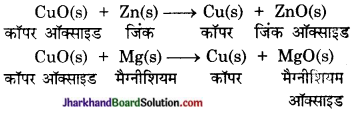
प्रश्न 1.
जिंक, मैग्नीशियम एवं कॉपर के धात्विक ऑक्साइडों को निम्न धातुओं के साथ गर्म किया गया-
| धातु | जिंक | मैग्नीशियम | कॉपर |
| जिंक ऑक्साइड | |||
| मैग्नीशियम ऑक्साइड | |||
| कॉपर ऑक्साइड |
किस स्थिति में विस्थापन अभिक्रिया घटित होगी?
उत्तर:
(i) जब जिंक ऑक्साइड को मैग्नीशियम के साथ गर्म किया जाता है तो जिंक ऑक्साइड मैग्नीशियम के साथ द्विविस्थापन अभिक्रिया करके निम्न प्रकार से उत्पाद बनाएगा-

(ii) और (iii) जब मैग्नीशियम ऑक्साइड और कॉपर ऑक्साइड को जिंक के साथ गर्म किया जाता है तो कोई भी अभिक्रिया उत्पन्न नहीं होती है।
प्रश्न 2.
कौन सी धातु आसानी से संक्षारित नहीं होती है?
उत्तर:
सोना, चाँदी और कॉपर आदि धातुएँ आसानी से संक्षारित नहीं होतीं।
प्रश्न 3.
मिश्रधातु क्या होते हैं?
उत्तर:
दो या दो से अधिक धातुओं के समांगी मिश्रण को मिश्रधातु कहते हैं। इसे तैयार करने के लिए पहले मूल धातु को गलित किया है और फिर दूसरे तत्त्वों को एक निश्चित अनुपात में इसमें विलीन किया जाता है। फिर इसे कमरे के तापमान पर ठंडा किया जाता है।
क्रिया-कलाप – 3.1
प्रश्न 1.
आयरन, कॉपर, ऐलुमिनियम और मैग्नीशियम के नमूने लीजिए। प्रत्येक नमूना कैसा दिखाई देता है उस पर ध्यान दीजिए।
उत्तर:
आयरन, कॉपर, ऐलुमिनियम और मैग्नीशियम के नमूने हल्के चमकदार दिखाई देते हैं।
प्रश्न 2.
रेगमाल से रगड़कर प्रत्येक नमूने की सतह को साफ करके उसके स्वरूप पर फिर से ध्यान दीजिए।
उत्तर:
रेगमाल से रगड़ने पर प्रत्येक नमूने की सतह को साफ करने पर इन नमूनों की चमक बढ़ जाती है। धातु के इस गुणधर्म को धात्विक चमक कहते हैं।
क्रिया-कलाप – 3.2
प्रश्न 1.
आयरन, कॉपर, ऐलुमिनियम तथा मैग्नीशियम धातुओं को तेज धार वाले चाकू से काटने का प्रयास करें तथा अपने प्रेक्षणों को दर्ज करें।
उत्तर:
ये धातुएँ काटने में बहुत कठोर हैं।
प्रश्न 2.
सोडियम को चाकू से काटिए। आपने क्या देखा?
उत्तर:
सोडियम को चाकू की सहायता से आसानी से काटा जा सकता है।
![]()
क्रिया-कलाप – 3.3
- आयरन, जिंक, लेड तथा कॉपर के टुकड़े लीजिए।
- किसी एक धातु को लोहे के ब्लॉक (खंड) पर रखकर चार-पाँच बार हथौड़े से प्रहार कीजिए। आपने क्या देखा?
- अन्य धातुओं के साथ भी यही क्रिया कीजिए।
क्रिया-कलाप के प्रश्नोत्तर
प्रश्न 1.
इन धातुओं के आकार में हुए परिवर्तन को लिखिए।
उत्तर:
ये धातुएँ पीटने पर पतली चादर में बदल जाती हैं।
क्रिया-कलाप – 3.4
(i) अधातुओं की सूची बनाइए जिसके तार आप अपने दैनिक जीवन में देखते हैं।
क्रिया-कलाप के प्रश्नोत्तर
प्रश्न 1.
इनमें कौन-सी धातुएँ तार के रूप में भी उपलब्ध हैं?
उत्तर:
आयरन, कॉपर, ऐलुमिनियम तार के रूप में भी उपलब्ध हैं।
क्रिया-कलाप – 3.5
- ऐलुमिनियम या कॉपर का तार लीजिए। क्लैंप की मदद से इस तार को स्टैंड से कंस दीजिए जैसा चित्र में दिखाया गया है।
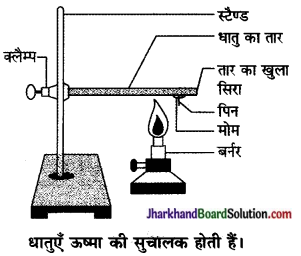
- तार के खुले सिर पर मोम का उपयोग कर एक पिन चिपका दीजिए।
- स्पिरिट लैंप, मोमबत्ती या बर्नर से क्लैंप के निकट तार को गर्म कीजिए।
क्रिया-कलाप के प्रश्नोत्तर
प्रश्न 1.
थोड़ी देर बाद आप क्या देखते हैं?
उत्तर:
मोम पिघल जाता है तथा सारे पिन नीचे गिर जाती हैं।
प्रश्न 2.
क्या धातु का तार द्रवित होता है?
उत्तर:
धातु का तार द्रवित नहीं होता है।
क्रिया-कलाप – 3.6
- चित्र की तरह एक विद्युत सर्किट (परिपथ) तैयार कीजिए।
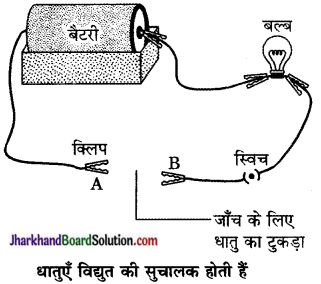
- जिस धातु की जाँच करनी है उसे परिपथ में टर्मिनल (A) तथा टर्मिनल (B) के बीच उसी प्रकार रखिए जैसा चित्र में दिखाया गया है।
क्रिया-कलाप के प्रश्नोत्तर
प्रश्न 1.
क्या बल्ब जलता है? इससे क्या पता चलता है?
उत्तर:
हाँ, बल्ब जलता है। इससे यह पता चलता है कि धातुएँ विद्युत की सुचालक होती हैं।
क्रिया-कलाप – 3.7
- कार्बन (कोल या ग्रेफाइट), सल्फर तथा आयोडीन के नमूने एकत्र कीजिए।
- इन अधातुओं से 3.1 से 3.6 तक के क्रिया-कलापों को दोहराइए तथा अपने प्रेक्षणों को लिखिए।
क्रिया-कलाप के प्रश्नोत्तर
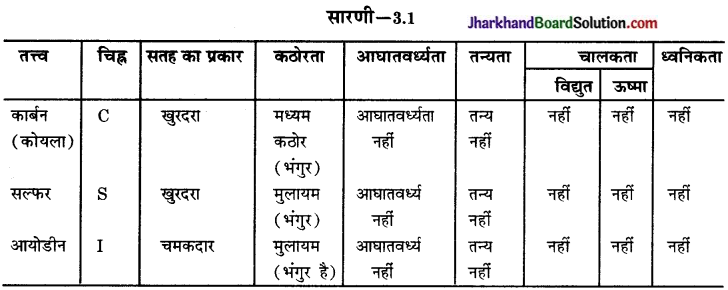
प्रश्न 1.
धातुओं एवं अधातुओं से सम्बन्धित अपने प्रेक्षणों को सारणी 3.1 में संकलित कीजिए।
उत्तर:
क्रिया-कलाप – 3.8
- मैग्नीशियम की एक पट्टी तथा थोड़ा सल्फर चूर्ण लीजिए।
- मैग्नीशियम की पट्टी का दहन कीजिए। उसकी राख को इकट्ठा करके उसे पानी में घोल दीजिए।
- लाल तथा नीले लिटमस पेपर से प्राप्त विलयन की जाँच कीजिए।
- अब सल्फर के चूर्ण का दहन कीजिए। दहन से उत्पन्न धुएँ को एकत्र करने के लिए उसके ऊपर एक परखनली रख दीजिए।
- इस परखनली में जल डालकर उसे अच्छी तरह मिला दीजिए।
- नीले तथा लाल लिटमस पेपर से इस विलयन की जाँच कीजिए।
क्रिया-कलाप के प्रश्नोत्तर
प्रश्न 1.
मैग्नीशियम के दहन से जो उत्पाद मिला है वह अम्लीय है या क्षारकीय?
उत्तर:
क्षारकीय।
प्रश्न 2.
सल्फर के दहन से उत्पन्न पदार्थ अम्लीय है या क्षारकीय।
उत्तर:
सल्फर के दहन से उत्पन्न पदार्थ अम्लीय है।
प्रश्न 3.
क्या आप इन अभिक्रियाओं के समीकरण लिख सकते हैं?
उत्तर:
- 2Mg + O2 → 2MgO
- S + O2 → SO2
- MgO + H2O → 1 Mg (OH) 2
- SO2 + H2O → H2SO3 सल्फ्यूरस अम्ल (एक अम्ल)
क्रिया-कलाप – 3.9
- एकत्र की गई किसी धातु को चिमटे से पकड़कर ज्वाला पर उसका दहन कीजिए।
- अन्य धातुओं के साथ भी यही क्रिया दोहराइए।
- इससे उत्पन्न पदार्थ को एकत्र कीजिए।
- उत्पाद तथा धातु की सतह को ठंडा होने दीजिए।
क्रिया-कलाप के प्रश्नोत्तर
प्रश्न 1.
किस धातु का दहन आसानी से होता है?
उत्तर:
सोडियम (Na) तथा मैग्नीशियम (Mg) का।
प्रश्न 2.
जब धातु का दहन हो रहा था, तो ज्वाला का रंग क्या था?
उत्तर:
Mg के दहन पर चमकदार श्वेत (सफेद) ज्वाला तथा Na के दहन पर पीले रंग की ज्वाला निकल रही थी।
![]()
प्रश्न 3.
दहन के पश्चात् धातु की सतह कैसी प्रतीत होती है?
उत्तर:
चाँदी की तरह श्वेत।
प्रश्न 4.
धातुओं को ऑक्सीजन के साथ अभि-क्रियाशीलता के आधार पर घटते क्रम में व्यवस्थित कीजिए।
उत्तर:
Na > Mg > Al > Zn > Fe > Pb > Cu.
प्रश्न 5.
क्या इनके उत्पाद जल में घुलनशील हैं?
उत्तर:
Mg, Al, Cu Fe Pb और Zn के उत्पाद घुलनशील नहीं हैं जबकि सोडियम के उत्पाद घुलनशील हैं।
क्रिया-कलाप – 3.10
- क्रिया-कलाप 3.9 की तरह समान धातुओं के नमूने एकत्र दीजिए।
- ठंडे जल से आधे भरे बीकर में नमूने के छोटे टुकड़ों को अलग-अलग डालिए।
- जो धातुएँ ठंडे जल के साथ अभिक्रिया नहीं करती हैं उन्हें ऐसे बीकरों में डालिए जो गर्म जल से आधे भरे हुए हों।
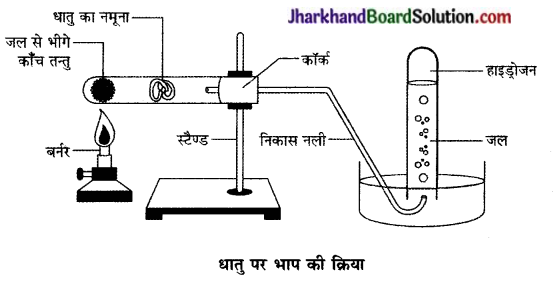
- जो धातुएँ गर्म जल के साथ अभिक्रिया नहीं करती उसके लिए चित्र की तरह उपकरण व्यवस्थित कीजिए तथा भाप के साथ उसकी अभिक्रिया को प्रेक्षित कीजिए।
क्रिया-कलाप के प्रश्नोत्तर
प्रश्न 1.
कौन-सी धातु ठंडे जल से अभिक्रिया करती है? ठंडे पानी के साथ अभिक्रियाशीलता के आधार पर उन्हें आरोही क्रम में व्यवस्थित कीजिए।
उत्तर:
सोडियम, पोटैशियम तथा कैल्सियम जल के साथ अभिक्रिया करते हैं। उनकी अभिक्रियाशीलता का आरोही क्रम निम्न है-
कैल्सियम < पोटैशियम < सोडियम
प्रश्न 2.
क्या कोई धातु जल में आग उत्पन्न करती है?
उत्तर:
हाँ, सोडियम एवं पोटैशियम।
प्रश्न 3.
क्या कोई धातु थोड़ी देर बाद जल में तैरने लगती है?
उत्तर:
हाँ, कैल्सियम तथा मैग्नीशियम।
प्रश्न 4.
कौन-सी धातुएँ भाप के साथ भी अभिक्रिया नहीं करती हैं?
उत्तर:
सीसा, कॉपर, चाँदी तथा सोना।
प्रश्न 5.
जल के साथ अभिक्रियाशीलता के आधार पर धातुओं को अवरोही क्रम में व्यवस्थित कीजिए।
उत्तर:
सोडियम > पोटैशियम > कैल्सियम > मैग्नीशियम > ऐलुमिनियम लोहा सीसा > कॉपर > चाँदी > पारा।
क्रिया-कलाप – 3.11
- सोडियम तथा पोटैशियम के अतिरिक्त बाकी सभी धातुओं के नमूने एकत्र कीजिए। यदि नमूने मलीन हैं तो रेगमाल से रगड़कर उन्हें साफ कर लीजिए।
- सावधानी – सोडियम तथा पोटैशियम को नहीं लीजिए क्योंकि वे ठंडे जल के साथ भी तेजी से अभिक्रिया करते हैं।
- नमूनों को अलग-अलग तनु हाइड्रोक्लोरिक अम्ल युक्त परखनलियों में डालिए।
- थर्मामीटर को परखनलियों में इस प्रकार लटका दें कि उसका बल्ब अम्ल में डूब जाए।
- बुलबुले बनने की दर का सावधानीपूर्वक प्रेक्षण कीजिए।
क्रिया-कलाप के प्रश्नोत्तर
प्रश्न 1.
कौन-सी धातुएँ तनु हाइड्रोक्लोरिक अम्ल के साथ तेजी से अभिक्रिया करती हैं?
उत्तर:
मैग्नीशियम।
प्रश्न 2.
आपने किस धातु के साथ सबसे अधिक ताप रिकॉर्ड किया?
उत्तर:
मैग्नीशियम।
प्रश्न 3.
तनु अम्ल के साथ अभिक्रियाशीलता के आधार पर धातुओं को अवरोही क्रम में व्यवस्थित कीजिए।
उत्तर:
Mg > Al > Zn > Fe.
क्रिया-कलाप – 3.12
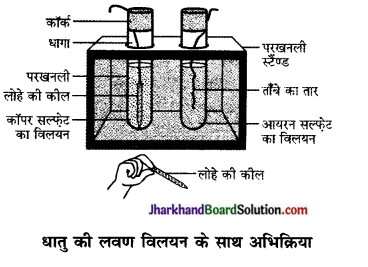
- कॉपर का एक स्वच्छ तार एवं आयरन की एक कील लीजिए।
- कॉपर के तार को परखनली में रखे आयरन सल्फेट के विलयन तथा आयरन की कील को दूसरी परखनली में रखे कॉपर सल्फेट के विलयन में डाल दीजिए।
- 20 मिनट के बाद अपने प्रेक्षणों को रिकॉर्ड कीजिए।
- आपको किस परखनली में कोई अभिक्रिया हुई है, इसका पता चलता है?
क्रिया-कलाप के प्रश्नोत्तर
प्रश्न 1.
किस परखनली में कोई अभिक्रिया हुई है?
उत्तर:
उस परखनली में जिसमें लोहे की कील को CuSO4 विलयन में डुबोया गया है।
प्रश्न 2.
किस आधार पर आप कह सकते हैं कि वास्तव में कोई अभिक्रिया हुई है?
उत्तर:
विलयन के रंग में परिवर्तन तथा कॉपर के जमा होने के आधारों पर हम कह सकते हैं कि कोई अभिक्रिया हुई है।
प्रश्न 3.
क्या आप अपने प्रेक्षणों को क्रिया-कलाप 3.9, 3.10 तथा 8.11 से कोई सम्बन्ध स्थापित कर सकते हैं?
उत्तर:
हाँ, लोहा, कॉपर से अधिक अभिक्रियाशील है।
![]()
प्रश्न 4.
इस अभिक्रिया के लिए संतुलित रासायनिक समीकरण लिखिए।
उत्तर:
Fe + CuSO4 → FeSO4 + Cu.
प्रश्न 5.
यह किस प्रकार की अभिक्रिया है?
उत्तर:
यह विस्थापन अभिक्रिया है।
क्रिया-कलाप – 3.13
- विज्ञान की प्रयोगशाला से सोडियम क्लोराइड, पोटैशियम आयोडाइड, बेरियम क्लोराइड या किसी अन्य लवण का नमूना लीजिए।
- धातु के स्पैचुला पर छोटी मात्रा में नमूने को लीजिए तथा इसे ज्वाला पर गर्म कीजिए। अन्य नमूनों के साथ भी यही क्रिया दोहराइए।
- आप क्या देखते हैं? क्या ये नमूने ज्वाला को रंग प्रदान करते हैं? क्या यौगिक पिघलते हैं?
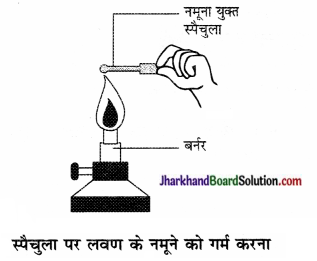
- नमूने को जल, पेट्रोल एवं किरोसिन में घोलने का प्रयास कीजिए। क्या ये घुलनशील हैं?
क्रिया-कलाप के प्रश्नोत्तर
प्रश्न 1.
इन लवणों की भौतिक अवस्था क्या है?
उत्तर:
इन लवणों की भौतिक अवस्था ठोस है।
प्रश्न 2.
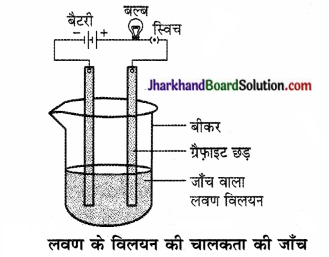
चित्र की तरह एक परिपथ बनाइए और किसी एक लवण के विलयन में इलैक्ट्रोड डाल दीजिए। आप क्या देखते हैं? इसी प्रकार अन्य लवण नमूनों की भी जाँच कीजिए।
उत्तर:
बल्ब जलने लगता है। इससे यह प्रदर्शित होता है कि लवण का विलयन विद्युत का सुचालक है।
प्रश्न 3.
इन यौगिकों की प्रकृति के सम्बन्ध में आप क्या निष्कर्ष निकालते हैं?
उत्तर:
- आयनिक यौगिक ठोस एवं कठोर होते हैं।
- आयनिक यौगिकों के द्रवणांक एवं क्वथनांक उच्च होते हैं।
- ये जल में विलयशील हैं किन्तु किरोसीन एवं पेट्रोल जैसे कार्बनिक विलायकों में अविलयशील हैं।
- ठोस अवस्था में आयनिक यौगिक विद्युत के सुचालक नहीं होते क्योंकि दृढ़ संरचना के कारण आयन गति नहीं कर पाते किंतु पिघली अवस्था में आयनिक यौगिक विद्युत के सुचालक होते हैं।
क्रिया-कलाप – 3.14
(i) तीन परखनली लीजिए एवं प्रत्येक में स्वच्छ लोहे की कीलें डाल दीजिए।
(ii) इन परखनलियों को A, B तथा C नाम दीजिए। परखनली A में थोड़ा जल डालकर एवं कॉर्क से बंद कर दीजिए।
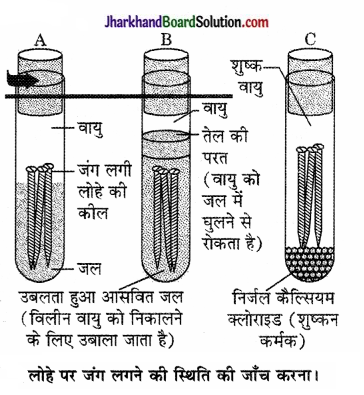
परखनली A में वायु एवं जल दोनों उपस्थित हैं। परखनली B में जल में विलीन वायु नहीं है। परखनली C में शुष्क वायु है।
(iii) परखनली B में उबलता हुआ आसवित जल डालकर उसमें 1 mL तेल मिलाइए एवं कॉर्क से बंद कर दीजिए। तेल जल पर तैरने लगेगा एवं वायु को जल में विलीन होने से रोक देगा।
(iv) परखनली C में थोड़ा निर्जल कैल्सियम क्लोराइड डालकर उसे कॉर्क से बंद कर दीजिए। निर्जल कैल्सियम क्लोराइड वायु की नमी को सोख लेगा। इन परखनलियों को कुछ दिन छोड़ने के बाद उनका प्रेक्षण कीजिए।
उत्तर:
छात्र स्वयं करें।