Jharkhand Board JAC Class 9 Science Solutions Chapter 3 परमाणु एवं अणु Textbook Exercise Questions and Answers.
JAC Board Class 9 Science Solutions Chapter 3 परमाणु एवं अणु
Jharkhand Board Class 9 Science परमाणु एवं अणु Textbook Questions and Answers
प्रश्न 1.
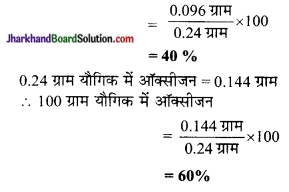
0.24 g ऑक्सीजन एवं बोरॉन युक्त यौगिक के नमूने में विश्लेषण द्वारा यह पाया गया कि उसमें 0.096g बोरॉन एवं 0.144g ऑक्सीजन है। उस यौगिक के प्रतिशत संघटन का भारात्मक रूप में परिकलन कीजिए।
हल:
0.24 ग्राम यौगिक में बोरॉन = 0.096 ग्राम
∴ 100 ग्राम यौगिक में बोरॉन
प्रश्न 2.
3.0g कार्बन 8.00g ऑक्सीजन में जलकर 11.00g कार्बन डाइऑक्साइड निर्मित करता है। जब 3.00g कार्बन को 50.00g ऑक्सीजन में जलाएँगे तो कितने ग्राम कार्बन डाइऑक्साइड का निर्माण होगा? आपका उत्तर रासायनिक संयोजन के किस नियम पर आधारित होगा?
उत्तर:
C + O2 → CO2
कार्बन का द्रव्यमान = 3g
ऑक्सीजन का द्रव्यमान = 8g
अभिकारकों का कुल द्रव्यमान = 3 + 8 = 11g
उत्पाद (CO2) का द्रव्यमान = 11 g
अतः अभिकारकों का कुल द्रव्यमान = उत्पाद का कुल द्रव्यमान
प्रश्नानुसार, कार्बन का द्रव्यमान = 3g
ऑक्सीजन का द्रव्यमान = 50g
अभिकारकों का कुल द्रव्यमान = 3 + 50 = 53 g
द्रव्यमान संरक्षण के नियमानुसार
अभिकारकों का कुल द्रव्यमान = उत्पाद का कुल द्रव्यमान
∴ उत्पाद का कुल द्रव्यमान = 53 g
यह रासायनिक संयोग ‘द्रव्यमान संरक्षण नियम’ पर आधारित है।
![]()
प्रश्न 3.
बहु परमाणुक आयन क्या होते हैं? उदाहरण दीजिए।
उत्तर:
परमाणुओं के समूह जिन पर नेट आवेश विद्यमान है उसे बहुपरमाणुक आयन कहते हैं। जैसे अमोनियम (NH4)+ सल्फेट (SO4)2- आदि।
प्रश्न 4.
निम्नलिखित के रासायनिक सूत्र लिखिए-
(a) मैग्नीशियम क्लोराइड
(b) कैल्सियम क्लोराइड
(c) कॉपर नाइट्रेट
(d) ऐलुमिनियम क्लोराइड
(e) कैल्सियम कार्बोनेट
उत्तर:
(a) मैग्नीशियम क्लोराइड का सूत्र
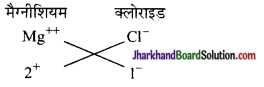
मैग्नीशियम क्लोराइड MgCl2
(b) कैल्सियम क्लोराइड का सूत्र
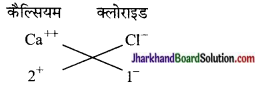
कैल्सियम क्लोराइड = CaCl2
(c) कॉपर नाइट्रेट का सूत्र कॉपर
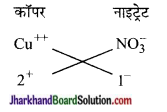
कॉपर नाइट्रेट = Cu(NO3)2
(d) एलुमिनियम क्लोराइड का सूत्र ऐलुमिनियम
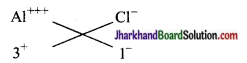
एलुमिनियम क्लोराइड AlCl3
(e) कैल्सियम कार्बोनेट का सूत्र
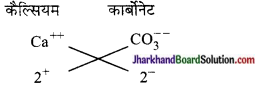
कैल्सियम कार्बोनेट = CaCO3
प्रश्न 5.
निम्नलिखित यौगिकों में विद्यमान तत्वों का नाम लिखिए-
(a) बुझा हुआ चूना
(b) हाइड्रोजन ब्रोमाइड
(c) बेकिंग पाउडर (खाने वाला सोडा)
(d) पोटैशियम सल्फेट
उत्तर:
| यौगिक का नाम | रासायनिक | उपस्थित तत्व |
| (a) बुझा हुआ चूना | Ca(OH)2 | कैल्सियम, ऑक्सीजन व हाइड्रोजन |
| (d) हाइड्रोजन ब्रोमाइड | HBr | हाइड्रोजन, ब्रोमीन |
| (c) बेकिंग पाउडर | NaHCO3 | सोडियम, हाइड्रोजन, कार्बन, ऑक्सीजन |
| (d) पोटैशियम | K2SO4 | पोटैशियम, सल्फर, ऑक्सीजन |
प्रश्न 6.
निम्नलिखित पदार्थों में मोलर द्रव्यमान का परिकलन कीजिए-
(a) एथाइन, C2H2
(b) सल्फर अणु, S8
(c) फॉस्फोरस अणु, P4 (फॉस्फोरस का परमाणु द्रव्यमान – 31)
(d) हाइड्रोक्लोरिक अम्ल, HCl
(e) नाइट्रिक अम्ल HNO3
उत्तर:
किसी पदार्थ के एक मोल अणु के द्रव्यमान को उसका मोलर द्रव्यमान कहते हैं।
(a) कार्बन का परमाणु द्रव्यमान = 12 u
हाइड्रोजन का परमाणु द्रव्यमान = 1 u
C2H2 का
अणु द्रव्यमान = 2 × C का
परमाणु द्रव्यमान (परमाणु द्रव्यमान ) + 2 × H का परमाणु द्रव्यमान = 2 × 12 + 2 + 1
= 24 + 2
= 26u.
∴ C2H2 का मोलर द्रव्यमान = 26g
(b) सल्फर का परमाणु द्रव्यमान = 32
S8 का अणु द्रव्यमान = 8 x 32
= 256 g
∴ S8 का मोलर द्रव्यमान = 256 g
(c) फास्फोरस का परमाणु द्रव्यमान = 31 u
P4 का अणु द्रव्यमान = 4 × 31 = 124 u
∴ P4 का मोलर द्रव्यमान = 124 g
(d) हाइड्रोजन का परमाणु द्रव्यमान = 1 u
क्लोरीन का परमाणु द्रव्यमान = 35.5u
HCl का अणु द्रव्यमान = H का परमाणु द्रव्यमान + Cl का परमाणु द्रव्यमान
∴ HCI का मोलर द्रव्यमान = 36.5 g
(e) हाइड्रोजन का परमाणु द्रव्यमान = 1 u
नाइट्रोजन का परमाणु द्रव्यमान = 14u
ऑक्सीजन का परमाणु द्रव्यमान = 16u
HNO3 का अणु द्रव्यमान H का परमाणु द्रव्यमान + N का परमाणु द्रव्यमान + 3 x O का परमाणु द्रव्यमान
= 1 + 14 + 3 × 16
= 1 + 14 + 48
= 63 g
∴ HNO3 का मोलर द्रव्यमान = 63g
![]()
प्रश्न 7.
निम्न का द्रव्यमान क्या होगा?
(a) 1 मोल नाइट्रोजन परमाणु
(b) 4 मोल ऐलुमिनियम का परमाणु (ऐलुमिनियम का परमाणु द्रव्यमान = 27 )
(c) 10 मोल सोडियम सल्फाइट (Na2 SO3)
उत्तर:
मोलर द्रव्यमान आयन के परमाणु द्रव्यमान के बराबर होता है।
(a) मोल संख्या (n) = 1
N परमाणुओं का मोलर द्रव्यमान (M) = 14g
द्रव्यमान = मोलर द्रव्यमान मोल संख्या
द्रव्यमान = 14 × 1 = 14 g
(b) मोल संख्या (n) = 4
ऐलुमिनियम आयनों का मोलर द्रव्यमान (M) = 27 ग्रा.
(समान तत्व के एक आयन का द्रव्यमान उसके परमाणु के द्रव्यमान के बराबर होता है।)
द्रव्यमान = मोलर द्रव्यमान x मोल संख्या
m = 27 x 4 = 108 g
(c) मोल संख्या (n) = 10
Na2SO3 का मोलर द्रव्यमान (M)
= 2 × 23 + 32 + 3 × 16
= 46 + 32 + 48 = 126
द्रव्यमान मोलर द्रव्यमान मोल संख्या
m = 126 × 10 = 1260 g
प्रश्न 8.
मोल में परिवर्तित कीजिए-
(a) 12 g ऑक्सीजन गैस
(b) 20g जल
(c) 22 g कार्बन डाइऑक्साइड
उत्तर:
(a) ऑक्सीजन गैस का परमाणु द्रव्यमान = 32 u
∴ O2 का मोलर द्रव्यमान (m) = 32 g
ऑक्सीजन का दिया गया द्रव्यमान (m) = 12 g

मोलों की संख्या = \(\frac { 12 }{ 32 }\) = 0.375 मोल
(b) जल का अणु द्रव्यमान = 18 u
जल का मोलर द्रव्यमन = 18 u
जल का दिया गया द्रव्यमान = 20 g

मोलों की संख्या = \(\frac { 20 }{ 18 }\) = 1.11 मोल
(c) 22 ग्राम CO2 में मोलों की संख्या = \(\frac { 22 }{ 44 }\)
= 0.5 मोल
प्रश्न 9.
निम्न का द्रव्यमान क्या होगा?
(a) 0.2 मोल ऑक्सीजन परमाणु
(b) 0.5 मोल जल अणु
उत्तर:
(a) मोल ऑक्सीजन संख्या (n) = 0.2
ऑक्सीजन का परमाणु द्रव्यमान = 16u
ऑक्सीजन का मोलर द्रव्यमान (M) = 16g
द्रव्यमान = मोलर द्रव्यमान x मोल संख्या
द्रव्यमान = 16 x 0.2 = 3.2 g
(b) मोल जल अणु (n) = 0.5
जल का अणु द्रव्यमान = 18 u
जल का मोलर द्रव्यमान = 18 u
द्रव्यमान = मोलर द्रव्यमान × मोल संख्या
द्रव्यमान = 18 x 0.5 = 9 g
प्रश्न 10.
16 g ठोस सल्फर में सल्फर (S8) के अणुओं की संख्या का परिकलन कीजिए।
उत्तर:
सल्फर का परमाणु द्रव्यमान = 32 u
S8 अणु का मोलर द्रव्यमान = 32 x 8 = 256 u
S8 अणु का प्रदत्त द्रव्यमान (m) = 16 g
आवोगाद्रो स्थिरांक (NA) = 6.022 × 1023
कणों (अणुओं) की संख्या

प्रश्न 11.
0.051g ऐलुमिनियम ऑक्साइड (Al2O3) में ऐलुमिनियम आयन की संख्या का परिकलन कीजिए।
संकेत-किसी आयन का द्रव्यमान उतना ही होता है जितना कि उस तत्व के परमाणु का द्रव्यमान होता है। ऐलुमिनियम का परमाणु द्रव्यमान 27 u है।
उत्तर:
ऐलुमिनियम ऑक्साइड (Al2 O3) का अणु द्रव्यमान
= 2 × 27 + 3 x 16
= 54 + 48 = 102 u
Al2O3 का मोलर द्रव्यमान (M) = 102 g
Al2O3 का प्रदत्त द्रव्यमान (m) = 0.051 g
आवोगाद्रो स्थिरांक (NA) = 6.022 × 1023
कणों (आयनों) की संख्या (N)

N = \(\frac { m }{ M }\) × NA
N = \(\frac { 0.051 }{ 102 }\) × 6.022 × 1023
N = 0.003011 × 1023
चूँकि Al2 O3 का प्रत्येक अणु दो ऐलुमिनियम आयन धारण किए हुए है,
अतः ऐलुमिनियम तत्वों की संख्या
= 2 x 0.003011 × 1023
= 0.006022 × 1023
= 6.022 × 1020
Jharkhand Board Class 9 Science परमाणु एवं अणुं InText Questions and Answers
क्रियाकलाप 1.
निम्न X तथा Y रसायनों का एक युगल लीजिए-
| X | Y |
| (i) कॉपर सल्फेट | सोडियम कार्बोनेट |
| (ii) बेरियम क्लोराइड | सोडियम सल्फेट |
| (iii) लेड नाइट्रेट | सोडियम क्लोराइड |
X तथा Y युगलों की सूची में से किसी एक युगल के रसायनों के अलग-अलग 5% विलयन जल में तैयार करंके Y के विलयन की कुछ मात्रा को एक शंक्वाकार फ्लास्क में लेकर X के विलयन की कुछ मात्रा को एक ज्वलन नली में लीजिए।
ज्वलन नली को विलेय युक्त फ्लास्क में इस प्रकार लटकाना है कि दोनों विलयन आपस में मिश्रित न हों तथा फ्लास्क के मुख पर कॉर्क चित्र की भाँति लगाइए-
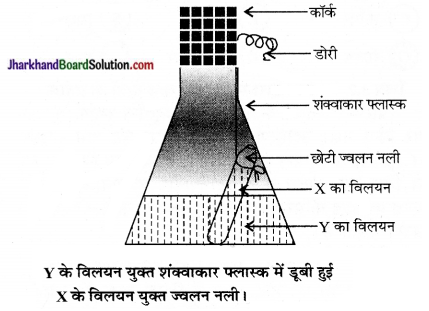
- अन्दर समाहित वस्तु सहित फ्लास्क को सावधानी पूर्वक तोला।
- अब फ्लास्क को झुकाकर इस प्रकार घुमायें कि X व Y के विलयन परस्पर मिश्रित हो जाएँ।
- इस फ्लास्क को पुनः तौलकर देखें कि क्या कोई रासायनिक अभिक्रिया हुई?
- क्या फ्लास्क के द्रव्यमान एवं अंतर्वस्तुओं में कोई परिवर्तन हुआ?
द्रव्यमान संरक्षण के नियमानुसार “किसी रासायनिक अभिक्रिया में द्रव्यमान का न तो सृजन किया जा सकता है और न ही विनाश। ”
खंड 3.1 पर आधारित पाठ्य पुस्तक के प्रश्न (पा. पु. पू. सं. 36)
प्रश्न 1.
एक अभिक्रिया में 5.3g सोडियम कार्बोनेट एवं 6.0g एसीटिक अम्ल अभिकृत होते हैं। 2.2g कार्बन डाइऑक्साइड, 8.2g सोडियम एसीटेट एवं 0.9g जल उत्पाद के रूप में प्राप्त होते हैं। इस अभिक्रिया द्वारा दिखाइए कि यह परीक्षण द्रव्यमान संरक्षण के नियम के अनुरूप है।
सोडियम कार्बोनेट + एसीटिक अम्ल → सोडियम एसीटेट + कार्बन डाइऑक्साइड + जल
उत्तर:

अभिकारकों का द्रव्यमान = 5.3 + 6.0 = 11.3 g
उत्पादों का द्रव्यमान = 8.2g + 2.2g + 0.9g = 11.3 g
इस अभिक्रया में अभिकारकों तथा उत्पादों का द्रव्यमान समान है अतः यह द्रव्यमान संरक्षण के नियम के अनुसार है।
प्रश्न 2.
हाइड्रोजन एवं ऑक्सीजन द्रव्यमान के अनुसार 18 के अनुपात में संयोग करके जल निर्मित करते हैं। 3g हाइड्रोजन गैस के साथ पूर्ण रूप से संयोग करने के लिए कितने ऑक्सीजन गैस के द्रव्यमान की आवश्यकता होगी?
उत्तर:

1g हाइड्रोजन 8g ऑक्सीजन के साथ संयोग करके 9gm जल बनाती है।
∵ 1g हाइड्रोजन के लिए आवश्यक ऑक्सीजन 8g
∴ 3g हाइड्रोजन के लिए आवश्यक ऑक्सीजन
= \(\frac { 1 }{ 8 }\) x 3 = 24g
अतः 3g हाइड्रोजन गैस के साथ पूर्ण रूप से संयोग करने के लिए 24g ऑक्सीजन गैस की आवश्यकता होगी।
अतः द्रव्यमान अनुपात = 3 : 24 ⇒ 18
अत: यह अभिक्रिया स्थिर अनुपात के नियम का अनुसरण करती है।
![]()
प्रश्न 3.
डाल्टन के परमाणु सिद्धान्त का कौन-सा अभिग्रहीत द्रव्यमान के संरक्षण के नियम का परिणाम है?
उत्तर:
डाल्टन के सिद्धान्त का दूसरा अभिग्रहीत “परमाणु अविभाज्य सूक्ष्मतम कण होते हैं जो रासायनिक क्रिया में न तो सृजित होते हैं और न ही उनका विनाश होता है।”
प्रश्न 4.
डाल्टन के परमाणु सिद्धान्त का कौन-सा अभिग्रहीत निश्चित अनुपात के नियम की व्याख्या करता है?
उत्तर:
भिन्न-भिन्न तत्वों के परमाणु परस्पर छोटी पूर्ण संख्या के अनुपात में संयोग कर यौगिक निर्मित करते हैं तथा किसी भी यौगिक में परमाणु की सापेक्ष संख्या एवं प्रकार निश्चित होते हैं। परमाणु सिद्धान्त का यह अभिग्रहीत निश्चित अनुपात नियम की व्याख्या करता है।
खण्ड-3 पर आधारित पाठ्य पुस्तक के प्रश्न (पा. पु. पृ. सं. – 40)
प्रश्न 1.
परमाणु द्रव्यमान इकाई को परिभाषित कीजिए।
उत्तर:
- कार्बन – 12 समस्थानिक को मानक सन्दर्भ के रूप में सार्वभौमिक रूप से स्वीकार किया गया था।
- कार्बन – 12 समस्थानिक के एक परमाणु द्रव्यमान के 1/12 वें भाग को मानक परमाणु द्रव्यमान इकाई कहते हैं।
प्रश्न 2.
एक परमाणु को आँखों द्वारा देखना क्यों सम्भव नहीं होता है?
उत्तर:
परमाणु का आकार अत्यन्त सूक्ष्म होता है। अतः परमाणु का आँखों द्वारा देखना संभव नहीं होता है।
क्रियाकलाप 2.
सारणी 3.5 अणुओं में विद्यमान परमाणुओं के द्रव्यमान अनुपातों तथा सारणी 3.3 को परमाणु द्रव्यमान के लिए देखें।
सारणी 3.5 में दिए गए यौगिकों के अणुओं में प्रयुक्त तत्वों के परमाणुओं की संख्या के अनुपातों को ज्ञात कीजिए। जल के अणु में प्रयुक्त परमाणुओं की संख्याओं का अनुपात निम्न प्रकार से प्राप्त किया जा सकता है।
| तत्व | द्रव्यमान अनुपात | परमाणु द्रव्यमान (u) | द्रव्यमान अनुपात/ परमाणु द्रव्यमान | सरलतम अनुपात |
| H | 1 | 1 | \(\frac { 1 }{ 1 }\) = 1 | 2 |
| O | 8 | 16 | \(\frac { 8 }{ 16 }\) = \(\frac { 1 }{ 2 }\) | 1 |
अतः जल के अणु में प्रयुक्त परमाणुओं की संख्याओं का अनुपात H : O = 2 : 1 है।
खण्ड 3.4 से सम्बन्धित पाठ्य पुस्तक के प्रश्न (पा. पु. पृ. सं. -44)
प्रश्न 1.
निम्न के सूत्र लिखिए-
(i) सोडियम ऑक्साइड
(ii) ऐलुमिनियम क्लोराइड
(iii) सोडियम सल्फाइड
(iv) मैग्नीशियम हाइड्रॉक्साइड
उत्तर:
(i) सोडियम ऑक्साइड
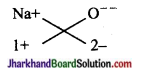
सूत्र Na2O
(ii) ऐलुमिनियम क्लोराइड
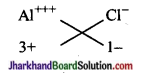
सूत्र AlCl3
(iii) सोडियम सल्फाइड
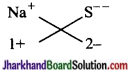
सूत्र Na2S
(iv) मैग्नीशियम हाइड्रॉक्साइड
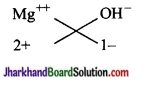
सूत्र Mg(OH)2
प्रश्न 2.
निम्नलिखित सूत्रों द्वारा प्रदर्शित यौगिकों के नाम लिखिए-
- Al2(SO4)3
- CaCl2
- K2SO4
- KNO3
- CaCO3
उत्तर:
- ऐलुमिनियम सल्फेट
- कैल्सियम क्लोराइड
- पोटैशियम सल्फेट
- पोटैशियम नाइट्रेट
- कैल्सियम कार्बोनेट
प्रश्न 3.
रासायनिक सूत्र का क्या तात्पर्य है?
उत्तर:
किसी यौगिक के संघटक तत्वों तथा संयोग करने वाले सभी तत्वों की परमाणु संख्या के प्रतीकात्मक निरूपण को रासायनिक सूत्र कहते हैं।
![]()
प्रश्न 4.
निम्नलिखित में कितने परमाणु विद्यमान हैं?
(i) H2S अणु एवं
(ii) PO43- आयन?
उत्तर:
(i) H2S अणु-इसमें तीन परमाणु (दो परमाणु हाइड्रोजन तथा एक परमाणु सल्फर) विद्यमान हैं।
(ii) PO43- आयन-इसमें पाँच परमाणु (एक परमाणु फॉस्फोरस तथा चार परमाणु ऑक्सीजन के विद्यमान हैं।
खण्ड 3.5 से सम्बन्धित पाठ्य पुस्तक के प्रश्न (पा. पु. पृ. सं. -46)
प्रश्न 1.
निम्नलिखित यौगिकों के आण्विक द्रव्यमान का परिकलन कीजिए-H2, O2, Cl2, CO2, CH4, C2H6, C2H4, NH3 एवं CH3OH
हल:
- H2 का आण्विक द्रव्यमान = 2 x 1 = 2 u
- O2 का आण्विक द्रव्यमान = 2 x 16 = 32 u
- Cl2 का आण्विक द्रव्यमान = 2 x 35.5 = 71 u
- CO2 का आण्विक द्रव्यमान = 1 x 12 + 2 x 16 = 44 u
- CH4 का आण्विक द्रव्यमान = 1 x 12 + 4 x 1 = 16 u
- C2H6 का आण्विक द्रव्यमान = 2 x 12 + 6 + 1 = 30 u
- NH3 का आण्विक द्रव्यमान = 2 x 12 + 4 x 1 = 28 u
- CH3OH का आण्विक द्रव्यमान = 1 x 12 + 3 x 1 + 1 x 16 + 1 x 1 = 32 u
प्रश्न 2.
निम्नलिखित यौगिकों के सूत्र इकाई द्रव्यमान का परिकलन कीजिए- ZnO, Na2O एवं K2CO3 दिया गया है-
Zn का परमाणु द्रव्यमान = 65 u,
Na का परमाणु द्रव्यमान = 23 u
K का परमाणु द्रव्यमान = 39 u,
C का परमाणु द्रव्यमान = 12 u एवं
O का परमाणु द्रव्यमान = 16 u है।
हल:
(i) ZnO का सूत्र इकाई द्रव्यमान =(1 × 65 + 1 × 16) u
= (65 + 16) u
= 81u
(ii) Na2O का सूत्र इकाई द्रव्यमान
=(2 × 23 + 1 × 16) u
= (46 + 16) u = 62 u
(iii) K2CO3 का सूत्र इकाई द्रव्यमान
= (2 × 39 + 1 × 12 + 3 x 16 ) u
= (78 + 12 + 48) u
= 138 u
खण्ड 3.5 से सम्बन्धित पाठ्य पुस्तक के प्रश्न (पा. पु. पृ. सं. -48)
प्रश्न 1.
यदि कार्बन परमाणुओं के एक मोल का द्रव्यमान 12 ग्राम है तो कार्बन के एक परमाणु का द्रव्यमान क्या होगा?
हल:
कार्बन के एक मोल परमाणुओं अर्थात् 6.022 x 1023 परमाणुओं का द्रव्यमान = 12 ग्राम
अतः कार्बन के 1 परमाणु का द्रव्यमान होगा
= \(\frac{12}{6.022 \times 10^{23}}\) ग्राम
= 1.99 x 10-23 ग्राम
प्रश्न 2.
किसमें अधिक परमाणु होंगे – 100g सोडियम अथवा 100g लोहा (Fe)? (Na का परमाणु द्रव्यमान = 23 u Fe का परमाणु द्रव्यमान = 56 u)
हल:
सोडियम (Na) का परमाणु द्रव्यमान = 23 u
सोडियम (Na) का मोलर द्रव्यमान = 23 ग्राम
मोलों की संख्या n = \(\frac { n }{ M }\) = \(\frac { 100 g }{ 23 g }\) = 4.35 मोल
इसी प्रकार Fe के मोलों की संख्या = \(\frac { 100 }{ 56 }\) = 1.78 मोल
चूँकि सोडियम के मोलों की संख्या, Fe से अधिक है;
अत: Na के 100 ग्राम में अधिक परमाणु हैं।