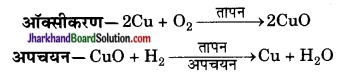Jharkhand Board JAC Class 10 Science Important Questions Chapter 1 रासायनिक अभिक्रियाएँ एवं समीकरण Important Questions and Answers.
JAC Board Class 10 Science Important Questions Chapter 1 रासायनिक अभिक्रियाएँ एवं समीकरण
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
किस नियम पर, रासायनिक समीकरण का संतुलित करना आधारित है?
उत्तर:
रासायनिक समीकरण का संतुलित करना द्रव्यमान संरक्षण के नियम पर आधारित है।
प्रश्न 2.
रासायनिक समीकरण में प्रतीक (↓) एवं (↑) क्या प्रदर्शित करते हैं?
उत्तर:
प्रतीक (↑) गैसीय उत्पाद व प्रतीक (↓) अवक्षेप (ठोस) उत्पाद दर्शाता है।
प्रश्न 3.
जलीय अवस्था क्या है?
उत्तर:
किसी अभिकारक या उत्पाद का जल में विलयन उसकी जलीय अवस्था कहलाती है।
प्रश्न 4.
भोजन के पाचन में किस प्रकार की अभिक्रिया होती है?
उत्तर:
भोजन के पाचन में वियोजन अभिक्रिया होती है।

प्रश्न 5.
श्वसन में किस प्रकार की अभिक्रिया होती है?
उत्तर:
श्वसन में उपचयन एवं ऊष्माक्षेपी अभिक्रिया होती है।
प्रश्न 6.
वियोजन अभिक्रियाओं में ऊर्जा किस रूप में ली जाती है?
उत्तर:
वियोजन अभिक्रियाओं में ऊर्जा ऊष्मा, प्रकाश या विद्युत के रूप में ली जाती है।
प्रश्न 7.
अभिकारक व उत्पाद क्या है?
उत्तर:
अभिकारक – ऐसे पदार्थ जो रासायनिक अभिक्रियाओं में भाग लेते हैं अभिकारक कहलाते हैं।
उत्पाद – ऐसे पदार्थ जो रासायनिक अभिक्रिया के फलस्वरूप प्राप्त होते हैं उत्पाद कहलाते हैं।
प्रश्न 8.
बिना बुझे हुए चूने का रासायनिक सूत्र लिखिए।
उत्तर:
CaO.
प्रश्न 9.
रासायनिक अभिक्रियाओं से क्या समझते हैं? उदाहरण दीजिए।
उत्तर:
रासायनिक अभिक्रियाएँ- जब एक या एक से अधिक पदार्थ आपस में क्रिया करके नये पदार्थ का निर्माण करते हैं तो ऐसी अभिक्रियाओं को रासायनिक अभिक्रियाएँ कहते हैं।
उदाहरण – आयरन को सल्फर के साथ गर्म करने पर फेरस सल्फाइड बनता है।
प्रश्न 10.
एथिलीन पर हाइड्रोजन की क्रिया से एथेन बनता है, क्यों?
उत्तर:
एथिलीन एक असंतृप्त हाइड्रोकार्बन है जिसमें कार्बन परमाणु द्विआबन्ध द्वारा जुड़े होते हैं। जब ये हाइड्रोजन से क्रिया करते हैं तो इसका द्विआबन्ध टूट जाता है और नया एकल आबन्ध, आबन्ध द्वारा संतृप्त हाइड्रोजन एथेन बनाते हैं। यह योगशील अभिक्रिया के कारण होता है।
प्रश्न 11.
एकल विस्थापन अभिक्रिया किसे कहते हैं?
उत्तर:
एक विस्थापन अभिक्रिया – जब किसी यौगिक में उपस्थित एक तत्त्व या (एक परमाणु) को किसी दूसरे यौगिक के एक तत्त्व या (एक परमाणु), द्वारा हटाकर स्वयं उसका स्थान ले लेता है तो उसे एकल विस्थापन अभिक्रिया कहते हैं।
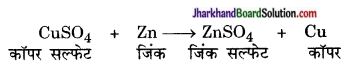
उदाहरण: CuSO4 + Zn → ZnSO4 + Cu
प्रश्न 12.
उपचयन व अपचयन अभिक्रियाओं को हम किस दूसरे नाम से जानते हैं?
उत्तर:
रेडॉक्स अभिक्रिया (Redox Reaction )।
प्रश्न 13.
उस अभिक्रिया का नाम बताइए जिसमें अविलेय लवण प्राप्त होता है?
उत्तर:
अवक्षेपण अभिक्रिया।

प्रश्न 14.
बेरियम सल्फेट तथा सोडियम क्लोराइड किन अभिकारकों से प्राप्त किये जा सकते हैं?
उत्तर:
- Na2SO4 ( सोडियम सल्फेट)
- BaCl2 (बेरियम क्लोराइड)
प्रश्न 15.
अभिक्रिया की गति प्रभावित करने वाले प्रमुख कारक कौन से हैं?
उत्तर:
- अभिकारकों की प्रकृति
- ताप
- सांद्रण
- उत्प्रेरक।
प्रश्न 16.
ऊष्माक्षेपी अभिक्रियाएँ किन्हें कहते हैं?
उत्तर:
ऊष्माक्षेपी अभिक्रियाएँ – वे रासायनिक अभिक्रियाएँ जिसमें ऊष्मा उत्पन्न या उत्सर्जित होती है, ऊष्माक्षेपी अभिक्रियाएँ कहलाती हैं।
उदाहरण – 1 मोल कार्बन और 1 मोल ऑक्सीजन संयोग करती है तो 1 मोल कार्बन डाइऑक्साइड बनती है तथा 44.3 k cal. ऊष्मा उत्पन्न होती है।
C + O2 → CO2 + 44.3 kcal
प्रश्न 17.
उत्क्रमणीय अभिक्रिया किसे कहते हैं?
उत्तर:
उत्क्रमणीय अभिक्रियाएँ वे अभिक्रियाएँ जो समान परिस्थितियों में अग्र एवं पश्च दोनों दिशाओं में होती हैं और किसी भी दिशा में पूर्णता को नहीं पहुँचतीं उत्क्रमणीय अभिक्रियाएँ कहलाती हैं।
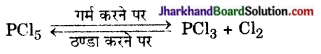
उदाहरण – जब फॉस्फोरस पेण्टाक्लोराइड को गर्म किया जाता है तब यह अपघटित होकर फ़ॉस्फोरस ट्राइ- इसे ठण्डा करने पर पुनः क्लोराइड तथा क्लोरीन देता है। फॉस्फोरस पेण्टाक्लोराइड प्राप्त हो जाता है।
PCl5 ⇌ PCl3 + Cl2
लघु उत्तरीय प्रश्न
प्रश्न 1.
रासायनिक साम्य किसे कहते हैं? सिद्ध कीजिए कि इसकी प्रकृति गतिज होती है।
उत्तर:
रासायनिक साम्य- किसी उत्क्रमणीय अभिक्रिया की वह अवस्था जिसमें अग्र व विपरीत दोनों अभिक्रियाओं के वेग बराबर हो जाते हैं, रासायनिक साम्यावस्था कहलाती है।
एक परखनली में कैडमियम क्लोराइड (CaCl2) के अम्लीय विलयन में H2S प्रवाहित करने पर कैडमियम सल्फाइड (Cds) का पीला अवक्षेप प्राप्त होता है।

इस स्थिति में सान्द्र HCl की कुछ बूँदें मिलाने पर अवक्षेप घुल जाता है और साफ विलयन प्राप्त हो जाता है। प्राप्त विलयन में H2S गैस प्रवाहित करने पर पुनः पीला अवक्षेप प्राप्त होता है। इस प्रयोग से सिद्ध होता है। कि रासायनिक साम्य की प्रकृति गतिज होती है।
प्रश्न 2.
ऊष्मीय वियोजन और आयनिक वियोजन में अन्तर लिखिए।
उत्तर:
ऊष्मीय वियोजन और आयनिक वियोजन में अन्तर
| ऊष्मीय वियोजन | आयनिक वियोजन |
| 1. ऊष्मीय वियोजन ऊष्मा के द्वारा होता है। | 1. आयनिक वियोजन विलयन बनाने पर होता है। |
| 2. ऊष्मीय वियोजन में उत्पाद उदासीन अणु होते हैं। | 2. आयनिक वियोजन में उत्पाद आयन होते हैं। |
| 3. ऊष्मीय वियोजन के लिये माध्यम आवश्यक नहीं है। | 3. आयनिक वियोजन के लिए माध्यम आवश्यक नहीं है। |
| 4. ऊष्मीय वियोजन में उत्पाद पृथक किये जा सकते हैं। | 4. आयनिक वियोजन के उत्पाद पृथक नहीं किये जा सकते। |
5. उदाहरण-
 | 5. उदाहरण-
 |
प्रश्न 3.
निम्नलिखित में से कौन-से परिवर्तन ऊष्माशोषी और कौन-से ऊष्माक्षेपी प्रकृति के हैं-
(a) फेरस सल्फेट का अपघटन
(b) सल्फ्यूरिक अम्ल का तनुकरण
(c) सोडियम हाइड्रॉक्साइड का जल में विलीन होना
(d) अमोनियम क्लोराइड का जल में विलीन होना।
उत्तर:
(b) तथा (c) ऊष्माक्षेपी हैं क्योंकि इन परिवर्तनों में ऊष्मा मुक्त होती है।
(a) तथा (d) ऊष्माशोषी हैं, क्योंकि इन परिवर्तनों में ऊष्मा अवशोषित होती है।
प्रश्न 4.
‘X’ समूह 2 के एक तत्त्व का ऑक्साइड है जो सीमेंट उद्योग में बहुत अधिक उपयोग में आता है। यह तत्त्व हड्डियों में भी उपस्थित रहता है। जल में अभिकृत कराने पर यह ऑक्साइड एक विलयन बनाता है, जो लाल लिटमस को नीला कर देता है। ‘X’ को पहचानिए तथा सम्बन्धित रासायनिक अभिक्रियाओं को भी लिखिए।
उत्तर:
X = कैल्सियम ऑक्साइड (बिना बुझा हुआ चूना)

प्रश्न 5.
प्राकृतिक गैस का दहन किस प्रकार की अभिक्रिया है? रासायनिक समीकरण द्वारा स्पष्ट कीजिए।
उत्तर:
यह एक ऊष्माक्षेपी रासायनिक अभिक्रिया है, क्योंकि उत्पाद के निर्माण के साथ-साथ ऊष्मा भी उत्पन्न होती है।

प्रश्न 6.
निम्नलिखित अभिक्रियाओं में अपचायक को पहचानिए-
(a) Fe2O3 + 3CO → 2Fe + 3CO2
(b) 4NH3 + 5O2 → 4NO + 6H2O
उत्तर:
(a) कार्बन मोनॉक्साइड (CO)।
(b) अमोनिया (NH3)।
प्रश्न 7.
निम्नलिखित अभिक्रियाओं में किसका ऑक्सीकरण तथा किसका अपचयन हुआ है?
(a) MnO2(aq) + 4HCl(aq) → MnCl2 (aq) + 2H2O(l) + Cl2(g)
(b) CuO(s) + H2(g) → Cu(s) + H2O(l)
उपर्युक्त अभिक्रियाओं का क्या नाम है?
उत्तर:
(a) HCl का उपचयन (ऑक्सीकरण) तथा MnO2 का अपचयन हुआ है।
(b) H2 का उपचयन तथा CuO का अपचयन हुआ है।
इन अभिक्रियाओं को उपचयन- अपचयन अथवा रेडॉक्स अभिक्रियाएँ कहते हैं।

प्रश्न 8.
क्या होता है जब आयरन धातु के टुकड़े को कॉपर सल्फेट विलयन में डुबोया जाता है?
उत्तर:
लोहे के टुकड़े का रंग भूरा हो जाता है तथा विलयन का रंग हरा हो जाता है। अभिक्रिया इस प्रकार होती है-

प्रश्न 9.
क्या होता है जब एक टुकड़ा-
(a) जिंक धातु का कॉपर सल्फेट विलयन में डाला जाता है।
(b) ऐलुमिनियम धातु का तनु हाइड्रोक्लोरिक अम्ल में डाला जाता है।
(c) सिल्वर धातु को कॉपर सल्फेट विलयन में डाला जाता है।
यदि अभिक्रिया सम्पन्न होती हो तो संतुलित रासायनिक समीकरण भी लिखिए।
उत्तर:
(a) चूँकि जिंक (Zn), कॉपर (Cu) से अधिक क्रियाशील धातु है इसलिए CuSO4 से Cu को विस्थापित कर देता है तथा जिंक सल्फेट का विलयन प्राप्त होता है।

यह विस्थापन अभिक्रिया का एक उदाहरण है।
(b) इसी प्रकार Al, हाइड्रोजन (H2) से अधिक क्रियाशील है, इसलिए तनु HCl से H2 गैस मुक्त कर देता है।
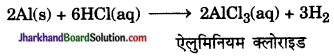
(c) Ag(s) + CuSO4 (aq) → कोई अभिक्रिया नहीं क्योंकि Ag, Cu से कम क्रियाशील धातु है अतः CuSO4 से Cu को विस्थापित नहीं कर पाती है।
प्रश्न 10.
विलोपन अभिक्रिया से क्या तात्पर्य है? एक उदाहरण द्वारा समझाइये।
उत्तर:
विलोपन अभिक्रिया वह सहसंयोजक रासायनिक अभिक्रिया जिसमें किसी यौगिक के अणु से एक सरल अणु निष्कासित (विलोपित) होता है विलोपन अभिक्रिया कहलाती है।
उदाहरण – जब एथिल ब्रोमाइड पर ऐल्कोहॉलीय पोटैशियम हाइड्रॉक्साइड की क्रिया करते हैं तो एक सरल अणु जल निष्कासित होता है।

प्रश्न 11.
उत्क्रमणीय एवं अनुत्कमणीय अभिक्रियाओं में अन्तर बताइये।
उत्तर:
उत्क्रमणीय एवं अनुत्क्रमणीय अभिक्रियाओं में अन्तर
| उत्क्रमणीय अभिक्रियाएँ | अनुत्क्रमणीय अभिक्रियाएँ |
| 1. ये अभिक्रियाएँ अग्र एवं पश्च दोनों दिशाओं में होती हैं। | 1. ये अभिक्रियाएँ एक ही दिशा में चलती हैं। |
| 2. इन अभिक्रियाओं में उत्पाद पुन: संयोजित होकर क्रियाकारकों को बनाते हैं। | 2. इन अभिक्रियाओं में उत्पाद पुनः संयोजित नहीं होते हैं। |
| 3. ये अभिक्रियाएँ कभी पूर्ण नहीं होतीं। | 3. ये अभिक्रियाएँ पूर्णता को प्राप्त होती हैं। |
4. उदाहरण-
 | 4. उदाहरण-
 |
प्रश्न 12.
कारण स्पष्ट करते हुए बताइए कि निम्नांकित परिवर्तन भौतिक हैं अथवा रासायनिक-
(i) गर्म करने पर मोम का पिघलना
(ii) मोमबत्ती का जलना
(iii) भोजन का पाचन
(iv) विद्युत् धारा प्रवाहित होने से तार का गर्म होना
(v) विद्युत धारा प्रवाहित होने से जल का हाइड्रोजन एवं ऑक्सीजन में विघटन
(vi) शुष्क चूने को जल में मिलाने पर जल का गर्म हो जाना
(vii) शर्करा घोलने पर का कुछ ठण्डा हो जाना
(viii) कॉपर सल्फेट विलयन में लोहे के टुकड़े डालने पर उनके रंग का काले से लाल हो जाना।
उत्तर:
(i) गर्म करने पर मोम का पिघलना भौतिक परिवर्तन है, क्योंकि इसमें मोम की केवल भौतिक अवस्था
(ठोस → द्रव) बदलती है-मोम की आणविक संरचना में कोई परिवर्तन नहीं होता।
(ii) मोमबत्ती का जलना-रासायनिक परिवर्तन है. क्योंकि मोम की ऑक्सीजन के साथ रासायनिक अभिक्रिया से नये पदार्थ (CO2 तथा H2O) बनते हैं।
(iii) भोजन का पाचन – भोजन का पाचन रासायनिक परिवर्तन है, क्योंकि पाचन क्रिया में अनेक रासायनिक अभिक्रियाओं यौगिक नये यौगिकों में परिवर्तित हो जाते हैं।
(iv) विद्युत् धारा प्रवाहित होने से तार का गर्म होना – भौतिक परिवर्तन है, क्योंकि इससे तार की भौतिक में ही परिवर्तन होता है-तार की संरचना नहीं बदलती।
(v) विद्युत् धारा प्रवाहित होने से जल का हाइड्रोजन एवं ऑक्सीजन में विघटन- यह रासायनिक परिवर्तन है क्योंकि जल से नये पदार्थ हाइड्रोजन एवं ऑक्सीजन बनते हैं।
(vi) शुष्क चूने को जल में मिलाने पर जल का गर्म हो जाना – यह रासायनिक परिवर्तन है, क्योंकि चूना (CaO) तथा जल (H2O) के रासायनिक संयोग से नया पदार्थ Ca(OH)2 बनता है।
(vii) शर्करा घोलने पर जल का कुछ ठण्डा हो ना- भौतिक परिवर्तन है, क्योंकि विलयन बनने पर शर्करा एवं जल का मिश्रण बनता है, कोई नया पदार्थ नहीं।
(viii) कॉपर सल्फेट विलयन लोहे के टुकड़े डालने पर उसके रंग का काले से लाल हो जाना – रासायनिक परिवर्तन है, क्योंकि कॉपर सल्फेट के विघटन से नया पदार्थ कॉपर बनता है जो लोहे के टुकड़ों पर एकत्र हो जाता है।
प्रश्न 13.
कारण देते हुए निम्नांकित अभिक्रियाओं को ऊष्माक्षेपी एवं ऊष्माशोषी में वर्गीकृत कीजिए-
(i) 2NH3 → N2 + 3H2 – 24 किलो कैलोरी
(ii) 2SO2 + O2 → 2SO3 + 25 किलो कैलोरी
(iii) N2 + O2 + 45 किलो कैलोरी → 2NO
उत्तर:
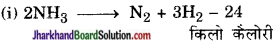
उपर्युक्त अभिक्रिया को निम्नवत् लिखा जा सकता है-
2 NH3 + 24 किलो कैलोरी N2 + 3H2
चूँकि अभिक्रिया सम्पन्न कराने हेतु NH3 को 24 किलो कैलोरी ऊष्मा देना आवश्यक है अतः यह ऊष्माशोषी अभिक्रिया है।
(ii) 2SO2 + O2 → 2SO3 + 25 किसी कॅलोरी अभिक्रिया में SO3 के साथ 25 किलो कैलोरी ऊष्मा भी प्राप्त होती है अतः यह ऊष्माक्षेपी अभिक्रिया है।
(iii) N2 + O2 + 45 किलो कैलोरी → NO
अभिक्रिया सम्पन्न होने के लिए N2 तथा O2 के साथ 45 किलो कैलोरी ऊष्मा भी देना आवश्यक है अतः यह ऊष्माशोषी अभिक्रिया है।

प्रश्न 14.
निम्नलिखित समीकरणों को संतुलित कीजिए-
(i) H2 + Br2 → HBr
(ii) Na + O2 → Na2O
(iii) P + O2 → P2O5
(iv) CO + O2 → CO2
(v) NaOH + H2SO4 → Na2SO4 + H2O
उत्तर:
(i) H2 + Br2 → HBr
H तथा Br के परमाणुओं की संख्या दोनों ओर समान करने के लिए HBr में 2 से गुणा करने पर
H2 + Br2 → 2HBr
(i) Na + O2 → Na2O
O की संख्या समान करने के लिए दाहिनी ओर 2 का गुणा करने पर
Na + O2 → 2 Na2O
अब Na की संख्या समान करने के लिए Na में 4 का गुणा करने पर

O के 1 परमाणु से Na के दो परमाणु संयोग करके 1 अणु Na2O बनाते हैं। अतः बायीं ओर O के 2 परमाणुओं से संयोग हेतु Na के 4 परमाणु चाहिए तथा इससे 2 अणु
Na2O के बनेंगे।
अतः 4 Na + O2 → 2Na2O
(iii) P + O2 → P2O5
P2O5 सूत्र के अनुसार P के 2 परमाणुओं परमाणु संयोग करते हैं। अतः P के 2 परमाणु लेने पर या O के 5 परमाणु 2 1/2 अणु लेने होंगे।
2P + 2 1/2 O2 → P2O5
परन्तु 1/2 अणु का कोई अर्थ नहीं है-अतः पूरे समीकरण में 2 का गुणा करने पर
4P + 5O2 → 2P2O5
(iv) CO + O2 → CO2
चूँकि O का एक परमाणु CO के एक अणु से संयोग करके CO2 बनाता है, O के दो परमाणु (O2), से CO के दो अणु संयोग करके 2 अणु CO2 बनायेंगे। अतः
2CO + O2 → 2CO2
(v) NaOH + H2SO4 → Na2SO4 + H2O
Na परमाणुओं की संख्या के संतुलन हेतु बायीं ओर NaOH के 2 अणु होने चाहिए। तदनुसार
2 NaOH + H2SO4 → Na2SO4 + H2O
अब H परमाणुओं की संख्या के संतुलन हेतु दाहिनी ओर H2O के दो अणु होने चाहिए – अतः
2NaOH + H2SO4 → Na2SO4 + 2H2O
दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
‘रासायनिक अभिक्रिया’ से क्या तात्पर्य है? इसके विभिन्न प्रकारों को, प्रत्येक का एक उदाहरण देकर स्पष्ट कीजिए।
उत्तर:
रासायनिक अभिक्रियाएँ (Chemical Reactions) जब कभी भी तत्त्व आपसी संयोग द्वारा यौगिकों का निर्माण करते हैं तब हम कह सकते हैं कि रासायनिक अभिक्रिया हुई। अथवा जब कभी भी भी यौगिक अपघ होकर दूसरे यौगिकों को बनाते हैं, तो रासायनिक अभिक्रियाएँ सम्पन्न होती हैं। अतः “ऐसी क्रियाएँ जिसमें एक या एक या एक से अधिक पदार्थों में उपस्थित परमाणुओं के पुनर्गठन के फलस्वरूप भिन्न पदार्थ या पदार्थों का निर्माण है, रासायनिक अभिक्रिया कहलाती है।”
उपर्युक्त परिभाषा से यह निष्कर्ष ष्कर्ष निकलता है कि रासायनिक अभिक्रिया ऐसी अभिक्रियाएँ हैं जिनके फलस्वरूप नये गुण वाले नये पदार्थ निर्मित होते हैं।
दूसरे शब्दों में “जब एक पदार्थ को किसी दूसरे पदार्थ के साथ क्रिया कराके अथवा कोई पदार्थ अकेले अपघटित होकर एक या एक से अधिक पदार्थ की रचना करता है तो यह क्रिया ही रासायनिक अभिक्रिया ही रासायनिक अभिक्रिया है।
उदाहरणस्वरूप, हाइड्रोजन एवं ऑक्सीजन के मिश्रण में जब चिनगारी की जाती है तब जल निर्मित होता है। इस प्रक्रिया में हाइड्रोजन एवं ऑक्सीजन के अणुओं में उपस्थित परमाणु पुनर्संगठित होकर जल के अणुओं की रचना करते हैं। इस अभिक्रिया को हम साधारणत: रासायनिक समीकरण के रूप में व्यक्त करते हैं।
हाइड्रोजन + ऑक्सीजन → जल
2H2 + O2 → 2H2O
ऊपर व्यक्त अभिक्रिया में हाइड्रोजन एवं ऑक्सीजन अभिकारक हैं। तीर (→) का निशान यह सूचित कर रहा है कि अभिक्रिया हो रही है एवं निर्मित यौगिक जल को उत्पाद कहते हैं।
रासायनिक अभिक्रियाएँ मुख्यतः निम्नलिखित प्रकारों की होती हैं-
- योगात्मक रासायनिक अभिक्रिया (Addition Chemical Reaction)
- प्रतिस्थापन रासायनिक अभिक्रिया (Substitu-tion Chemical Reaction)
- वियोजन अभिक्रिया (Dissociation)
- अपघटन अभिक्रिया (Decomposition)
- उभय-अपघटन (Double Decomposition)
(1) योगात्मक रासायनिक अभिक्रिया (Addition Chemical Reaction) – जिस अभिक्रिया में दो या दो से अधिक पदार्थ आपस में संयोग करके केवल एक पदार्थ बनाते हैं तथा कोई भी अन्य पदार्थ नहीं बनता उसे योगात्मक रासायनिक अभिक्रिया कहते हैं।
उदाहरण-

(2) प्रतिस्थापन रासायनिक अभिक्रिया ( Substi tution Chemical Reaction) – जिस अभिक्रिया में किसी यौगिक के अणु के किसी एक परमाणु या समूह के स्थान पर कोई दूसरा परमाणु या समूह जाता है, उसे प्रतिस्थापन रासायनिक अभिक्रिया कहते हैं।
उदाहरण-

(3) वियोजन अभिक्रिया (Dissociation Reaction ) – ऐसी रासायनिक अभिक्रियाएँ, जिनमें कोई पदार्थ रासायनिक अभिक्रिया को प्रेरित करने वाले कारणों (जैसे – ताप, दाब आदि) में परिवर्तन करने से दो अथवा से अधिक पदार्थों में विभक्त हो जाता तथा उपर्युक्त कारण हटा देने से पुनः मूल पदार्थ बन जाता है, वियोजन कहलाती है। वियोजन एक उत्क्रमणीय (Reversible) अभिक्रिया है। वियोजन अभिक्रियाएँ मुख्यतः दो प्रकार की होती हैं-
(i) ऊष्मीय वियोजन (Thermal Disso- ciation)- जब किसी यौगिक को गर्म करने से उसके अणु दो अथवा दो से अधिक छोटे अणुओं में परिवर्तित हो जाते हैं और ठण्डा करने पर वे फिर से मिलकर मूल
यौगिक बनाते हैं तब इस अभिक्रिया को ऊष्मीय अथवा तापीय वियोजन कहते हैं।
उदाहरणार्थ-

(ii) आयनिक वियोजन (Ionic Dissocia- tion) – किसी विद्युत् अपघद्य (Electrolyte) अथवा विद्युत्-संयोजी यौगिक (Electrovalent COmpound) को जल में घोला जाता है अथवा उच्च ताप तक गर्म करके गलित किया जाता है तो अणुओं का धनात्मक तथा ऋणात्मक आयनों में वियोजन हो जाता है। ये आयन विलयन में या गलित अवस्था में भी पुन: संयोजित होकर अणु बनाते रहते हैं। इस क्रिया को आयनिक वियोजन कहते हैं।
उदाहरण-
NaCl ⇌ Na+ + cr–
H2SO4 ⇌ 2.H+ + SO—
(4) अपघटन अभिक्रिया (Decomposition Reaction) – इस प्रकार की अभिक्रिया में किसी पदार्थ का अणु दो या दो से अधिक छोटे अणुओं या परमाणुओं में स्थायी रूप से विभक्त हो जाता है। यह क्रिया मुख्यत: दो प्रकार से से होती है-
(i) ऊष्मीय अपघटन अभिक्रिया (Thermal Decomposition Reaction) – वह रासायनिक अभिक्रिया जिसमें किसी पदार्थ को गर्म करने पर दो या दो से अधिक अवयवों में टूट जाय, परन्तु ठण्डा करने पर पुनः मूल पदार्थ न उसे ऊष्मीय अपघटन अभिक्रिया कहा जाता है। जैसे-
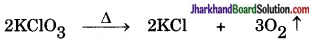
पोटैशियम क्लोरेट पोटैशियम क्लोराइड ऑक्सीजन गैस

(∆ चिन्ह ‘गरम करने’ अथवा ‘ऊष्मा’ को व्यक्त करता है)
(ii) विद्युत्-अपघटन अभिक्रिया (Electrolytic Decomposition Reaction) – इस प्रकार की क्रिया किसी विद्युत अपघट्य के विलयन या गलित अवस्था में विद्युत्-धारा प्रवाहित करने से होती है।
उदाहरणतः

(5) उभय अपघटन (Double Decomposi tion Reaction) – जिस रासायनिक अभिक्रिया में यौगिकों के आयनों या अवयवों की आपस में अदला-बदली होकर नये यौगिक बनते हैं, उसे उभय-अपघटन अभिक्रिया कहते हैं।
उदाहरण-
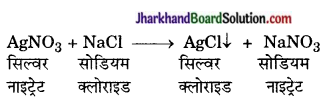
ये अभिक्रियाएँ मुख्यतः ऐसे दो यौगिकों के जलीय विलयनों के मिलाने से होती हैं, जिनमें से एक धनात्मक तथा एक ऋणात्मक आयन मिलकर कोई अविलेय यौगिक बनाते हैं. हैं, जो अवक्षेप अवक्षेप (Precipitate) 1 के रूप में विलयन से अलग हो जाता है। समीकरण में ↓ का चिन्ह, अवक्षेप को व्यक्त करता है।
प्रश्न 2.
रासायनिक समीकरण’ क्या होता है? इससे क्या “क्या जानकारियाँ मिलती हैं? कोई एक उदाहरण देकर बताइए एवं इसकी कमियाँ बताइए।
उत्तर:
रासायनिक समीकरण (Chemical Equation):
किसी भी रासायनिक परिवर्तन में एक या एक से अधिक पदार्थ परस्पर क्रिया करके नये पदार्थ (एक या अधिक) बनाते हैं। ऐसे परिवर्तन को गणितीय समीकरणों की भाँति एक समीकरण से व्यक्त किया जा सकता है। किसी रासायनिक परिवर्तन को व्यक्त करने वाले ऐसे समीकरण को रासायनिक समीकरण कहते हैं।
अभिक्रिया लिखने की विधि (Method of Written Reaction) – अभिक्रिया करने वाले अभिकारक (Reactants) समीकरण के या चिन्ह के बायीं ओर तथा अभिक्रिया के फलस्वरूप बने परिणामी पदार्थ (उत्पाद – Products) चिन्ह के दायीं ओर लिखे जाते हैं।
धन (+) चिन्ह दो या दो से अधिक अभिकारकों के बीच लगाया जाता है तथा परिणामी पदार्थों के बीच भी इसका प्रयोग कहते हैं। समीकरण के दोनों ओर प्रत्येक तत्त्व के परमाणुओं की संख्या समान कर ली जाती है अर्थात् समीकरण को सन्तुलित कर लिया जाता है। गैसों को सदैव अणु के रूप में लिखा जाता है
जैसे – Cl2, O2, N2, H2 आदि।
इस विधि से सिल्वर नाइट्रेट और हाइड्रोक्लोरिक अम्ल (तनु) की क्रिया के समीकरण को निम्नलिखित ढंग से लिख सकते हैं-
AgNO3 + HCl = AgCl + HNO3
किसी रासायनिक समीकरण से निम्नलिखित जानकारी मिलती है-
- अभिकर्मक तत्त्वों तथा यौगिकों के नाम एवं संघटन
- उत्पादों के नाम एवं संघटन
- रासायनिक अभिक्रिया में अभिकर्मकों तथा उत्पादों का द्रव्यमानात्मक अनुपात
- अभिकर्मक गैसों तथा उत्पादित गैसों का (समान दाब तथा ताप पर) आयतनात्मक अनुपात।
उदाहरणतः समीकरण

से ज्ञात होता है कि-
(i) नाइट्रोजन गैस तथा हाइड्रोजन गैस संयोग करके अमोनिया (NH3) गैस गैस बनाती हैं।
(ii) अमोनिया में नाइट्रोजन का 1 परमाणु तथा हाइड्रोजन के तीन परमाणु होते हैं।
(iii) रासायनिक क्रिया में द्रव्यमान के अनुसार नाइट्रोजन तथा हाइड्रोजन [2 × 14/6 × 1 = ] 14 : 3 के अनुपात में क्रिया करती है तथा इससे 17 भाग अमोनिया उत्पन्न होती है। [∵ नाइट्रोजन का परमाणु भार = 14 तथा हाइड्रोजन का परमाणु-भार = 1]
(iv) दोनों अभिकर्मक तथा उत्पाद गैसे हैं। आयतन , इनका अनुपात, इनके अणुओं की संख्या के अनुपात में होता है। अत: समान दाब तथा ताप पर अभिक्रिया में नाइट्रोजन, हाइड्रोजन तथा अमोनिया का अनुपात 1:3:2 होगा – अर्थात् 1 1 लीटर नाइट्रोजन तथा 3 लीटर हाइड्रोजन के संयोग से 2 लीटर अमोनिया बनेगी।
रासायनिक समीकरण की कमियाँ (Demerits of Chemical Equation) – रासायनिक समीकरण से यह ज्ञात नहीं होता कि-
- अभिकर्मकों की ली गयी तथा उत्पादों की उत्पन्न मात्राएँ क्या हैं।
- अभिक्रिया दाब एवं ताप की किन दशाओं में होती है।
- अभिक्रिया एकदिशीय (अनुत्क्रमणीय) है अथवा उत्क्रमणीय।
- अभिक्रिया में ऊर्जा अवशोषित होती है अथवा मुक्त।
प्रश्न 3.
संतुलित रासायनिक समीकरण की क्या पहचान है? किसी असंतुलित समीकरण को अनुमान विधि से संतुलित करने की क्रिया, एक सरल उदाहरण देकर समझाइए।
उत्तर:
संतुलित रासायनिक समीकरण (Balanced Chemical Equation) रासायनिक अभिक्रियाओं में न तो परमाणु नष्ट होते हैं, न नये परमाणु बनते हैं और न ही एक तत्त्व के परमाणु से किसी दूसरे तत्त्व का परमाणु बनता है। अतः रासायनिक समीकरण में उसके दोनों पक्षों में प्रत्येक तत्त्व के परमाणुओं की मात्रा समान होनी चाहिए। तभी वह समीकरण रासायनिक क्रिया को सही रूप में व्यक्त करता है। इस प्रकार के समीकरण को संतुलित समीकरण (Balanced Equation) कहते हैं।
उदाहरणतः हाइड्रोजन तथा ऑक्सीजन गैसों के संयोग से जल बनने की क्रिया को निम्नवत् लिखा जा सकता है-

उपर्युक्त समीकरण अभिक्रिया के अभिकर्मकों तथा उत्पाद को तो व्यक्त करता है परन्तु इसमें समीकरण के दोनों पक्षों में ऑक्सीजन परमाणुओं की संख्या समान नहीं है– अर्थात् यह समीकरण संतुलित नहीं है। संतुलित करने पर इसका स्वरूप निम्नवत् जाता है-
2H2 + O2 → 2H2O
समीकरण सन्तुलन का उदाहरण (अनुमान विधि) (Examples of Equation Balance) – सरल रासायनिक समीकरणों को (जिनमें दो से अधिक अभिकर्मक न हों), तत्त्वों के परमाणुओं को गिनकर, संतुलित किया जा सकता है। इसे अनुमान विधि भी कहते हैं। यद्यपि इस विधि में भी परमाणुओं की संख्या का संतुलन अनुमान मैं नहीं, वरन् गणितीय विधि से ही किया जाता है।]
उदाहरण 1.
H2 + O2 → H2O
(i) समीकरण के बाएँ पक्ष में दो 0 परमाणु हैं परन्तु दाहिने पक्ष में केवल एक, अतः दाहिने पक्ष में 2 अणु लेने से 0 परमाणुओं का संतुलन हो जाता है अर्थात्
H2 + O2 → 2H2O
(ii) अब दाहिने पक्ष में H के कुल 4 परमाणु बाएँ पक्ष में केवल 2 अतः बायीं ओर H2 में 2 का गुणा करने से H का संतुलन हो जाता है-
2H2 + O2 → 2H2O
अत: यह संतुलित समीकरण है।
प्रश्न 4.
(क) ‘मन्द’ तथा ‘तीव्र’ अभिक्रिया से क्या तात्पर्य है? एक-एक उदाहरण देकर बताइए।
(ख) रासायनिक अभिक्रिया की गति को मुख्यतः कौन-से कारक प्रभावित करते हैं?
उत्तर:
(क) मन्द अभिक्रियाएँ (Slow Reae- tions) – कुछ रासायनिक अभिक्रियाओं के पूरा होने में अधिक समय लगता है जैसे लोहे की वस्तु पर ऑक्सीजन की क्रिया से जंग (Rust) लगना किसी लोहे की वस्तु के पूरी तरह जंग में परिवर्तित होने में अनेक वर्ष लग सकते हैं। ऐसी क्रियाओं को मन्द अभिक्रियाएँ (Slow Reactions) कहते हैं।
मन्द अभिक्रियाओं में अभिकर्मकों का उत्पादों में परिवर्तन धीरे-धीरे अर्थात् अधिक समय में होता है।
उदाहरण- सल्फ्यूरिक अम्ल (H2SO4) की उपस्थिति में एथिल ऐल्कोहॉल (C2H5OH) ऐसीटिक अम्ल (CH3COOH) से क्रिया करके एथिल ऐसीटेट (CH3COOC2H5) और जल (H2O) बनाता है। इस अभिक्रिया को पूर्ण होने में अनेक मिनट लगते हैं। अतः यह एक मंद अभिक्रिया है।
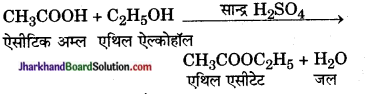
तीव्र – अभिक्रियाएँ (Rapid Reactions ) – तीव्र अभिक्रियाएँ अत्यन्त कम समय में ही पूरी हो जाती हैं। अभिकर्मकों को मिलाने पर इनके पूरे होने का समय 106 सेकण्ड (माइक्रो सेकण्ड ) के कोटिमान का होता है। तीव्र अभिक्रियाएँ मुख्यतः आयनों अथवा आयनिक यौगिकों के बीच होती हैं।
उदाहरण – सिल्वर नाइट्रेट (AgNO3) के विलयन को जब सोडियम क्लोराइड (NaCl) के विलयन में डालते तो सिल्वर क्लोराइड (AgCl) का तत्काल सफेद अवक्षेप (Precipitate) बनता है। यह एक तात्क्षणिक (Instan- taneous) अभिक्रिया है। अभिक्रिया है, क्योंकि आयनों के बीच होती है।

(ख) रासायनिक अभिक्रियाओं की गति को प्रभावित करने वाले प्रमुख कारक निम्नलिखित हैं- ताप, दाब, अभिकर्मकों की मात्राएँ तथा उत्प्रेरकों की उपस्थिति अथवा अनुपस्थिति। कुछ अभिक्रियाएँ नमी, प्रकाश आदि से भी प्रभावित होती हैं।
प्रश्न 5.
विस्थापन अभिक्रिया को उदाहरण सहित समझाइए।
अथवा
एकल विस्थापन अभिक्रिया एवं द्वि-विस्थापन अभिक्रिया को उदाहरण सहित समझाइये।
उत्तर:
विस्थापन अभिक्रिया – जब रासायनिक अभिक्रिया में एक तत्त्व (या पदार्थ) किसी दूसरे तत्त्व (या पदार्थ) को उसके यौगिक में से हटाकर स्वयं उसका स्थान ले लेता है तो उसे विस्थापन अभिक्रिया कहते हैं। ये दो प्रकार की होती हैं-
(i) एकल विस्थापन अभिक्रिया- किसी यौगिक में उपस्थित एक तत्त्व या (एक परमाणु) को इसके यौगिक के एक तत्त्व या (एक परमाणु) द्वारा हटाकर स्वयं उसका स्थान ले लेना एकल विस्थापन अभिक्रिया कहलाती है।
उदाहरण- कॉपर सल्फेट विलयन में जिंक धातु का टुकड़ा डालने पर जिंक द्वारा कॉपर का विस्थापन करके जिंक सल्फेट बनाता है।
द्वि-विस्थापन अभिक्रिया- ऐसी रासायनिक अभिक्रियाएँ जिसमें दो यौगिकों द्वारा परस्पर आयनों का विनिमय कर नये यौगिकों का निर्माण करते हैं तो इस क्रिया को द्वि-विस्थापन अभिक्रिया कहते हैं।
उदाहरण – जब सोडियम क्लोराइड के जलीय विलयन में सिल्वर नाइट्रेट विलयन मिलाते हैं तो आयनों का विनिमय कर सिल्वर क्लोराइड और सोडियम नाइट्रेट प्राप्त होता है।
Na+ Cl– + Ag+ NO–3 → AgCl + NaNO3

प्रश्न 6.
निम्नलिखित रासायनिक अभिक्रियाओं को परिभाषित कीजिए तथा एक-एक उदाहरण भी दीजिए-
(a) संयोजन अभिक्रिया
(b) वियोजन अभिक्रिया
(c) विस्थापन अभिक्रिया
(d) द्विविस्थापन अभिक्रिया
(e) उपचयन एवं अपचयन अभिक्रिया
उत्तर:
(a) संयोजन अभिक्रिया – ऐसी अभिक्रिया जिसमें या दो से अधिक अभिकारक मिलकर एक उत्पाद का निर्माण करते हैं, उसे संयोजन अभिक्रिया कहते हैं।
2Mg + O2 → 2MgO
(b) वियोजन या अपघटन अभिक्रिया – इसमें एकल पदार्थ वियोजित होकर दो या दो से अधिक पदार्थ बनाते हैं। वियोजन के लिए ऊष्मा, प्रकाश या विद्युत ऊर्जा की आवश्यकता होती है।

(c) विस्थापन अभिक्रिया – ऐसी अभिक्रिया जिसमें अधिक क्रियाशील तत्त्व, कम क्रियाशील तत्त्व को उसके यौगिक से विस्थापित कर दे, विस्थापन अभिक्रिया कहलाती है।
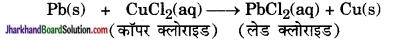
यहाँ लेड (Pb), कॉपर (Cu) की अपेक्षा अधिक क्रियाशील तत्त्व है, जो Cu को CuCl2 से हटा देता है।
(d) द्विविस्थापन अभिक्रिया – वे अभिक्रियाएँ जिसमें अभिकारकों के बीच आयनों का आदान-प्रदान होता है, उन्हें द्विविस्थापन अभिक्रियाएँ कहते हैं।
Na2SO4(aq) + BaCl2(aq) → BaSO4(s) + 2NaCl(aq)
यहाँ Ba2++ तथा SO42- आयनों की अभिक्रिया से BaSO4 अवक्षेप का निर्माण होता है।
(e) उपचयन – अपचयन अभिक्रिया – ऑक्सीजन का योग या हाइड्रोजन का ह्रास ऑक्सीकरण या उपचयन कहलाता है जबकि ऑक्सीजन का ह्रास या हाइड्रोजन का योग अपचयन कहलाता है।
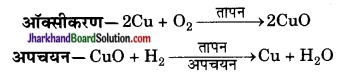
प्रश्न 7.
कारण देते हुए निम्नलिखित अभिक्रियाओं का प्रकार बताइए-
(i) Zn + 2 HCl → ZnCl2 + H2
(ii) N2 + 3H2 → 2NH3
(iii) CaO + CO2 → CaCO3
(iv) HCl ⇌ H+ + Cl–
(v) AgNO3 + KCl → KNO3 + AgCl
(vi) HNO3 + NaOH → NaNO3 + H2O
(vii) 2CO + O2 → 2CO2
(viii) C2H5Br + NaOH → C2H5OH + NaBr
उत्तर:
(i) Zn + 2 HCl → ZnCl2 + H2
यह प्रतिस्थापन अभिक्रिया है- क्योंकि HCl अणु से Zn परमाणु H परमाणु को हटाकर उसका स्थान लेता है।
(ii) N2 + 3H2 → 2NH3
योगात्मक अभिक्रिया है- क्योंकि N2 तथा H2 के संयोग से NH3 अणु बनता है।
(iii) CaO + CO2 → CaCO3
योगात्मक अभिक्रिया है, जिसमें CaO अणु तथा CO2 अणु का संयोजन होकर CaCO3 अणु बनता है।
(iv) HCl ⇌ H+ + Cl–
आयनिक- वियोजन की अभिक्रिया है, जिसमें HCl अणु का H+ तथा CH– आयनों में विघटन तथा इनका पुनः संयोजन होता रहता है।
(v) AgNO3 + KCl → KNO3 + AgCl
उभय- अपघटन अभिक्रिया है, क्योंकि AgNO3 तथा KCI के धनात्मक तथा ऋणात्मक आयनों के विनिमय से नये अण बनते हैं।
(vi) HNO3 + NaOH → NaNO3 + H2O
उदासीनीकरण अभिक्रिया है क्योंकि अम्ल (HNO3) तथा क्षार (NaOH) की पारस्परिक अभिक्रिया से जल तथा लवण (NaNO3) बनते हैं।
(vii) 2CO + O2 → 2CO2
योगात्मक अभिक्रिया है जिसमें CO तथा O2 के संयोग से CO2 बनता है।
(viii) C2H5Br + NaOH → C2H5OH + NaBr
प्रतिस्थापन अभिक्रिया है जिसमें C2H5 Br अणु से Br का प्रतिस्थापन OH द्वारा होता है।
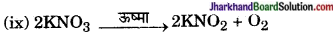
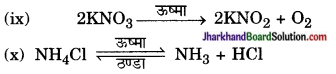
ऊष्मीय अपघटन है, क्योंकि ऊष्मा के प्रभाव से KNO3 का अपघटन होता है तथा KNO2 एवं O2 बनते हैं।
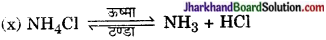
ऊष्मीय वियोजन की अभिक्रिया है- क्योंकि ऊष्मा के प्रभाव से NH4Cl का अणु NH3 तथा HCl में विघटित होता है तथा ये परस्पर पुनः संयोजित होकर NH4Cl बनाते रहते हैं।
बहुविकल्पीय प्रश्न
निर्देश- प्रत्येक प्रश्न में दिये गये वैकल्पिक उत्तरों में से सही विकल्प चुनिए-
1. नौसादर को गर्म करने पर यह अमोनिया और हाइड्रोजन क्लोराइड में टूट जाता है, ठण्डे में दोनों के संयोग से नौसादर बन जाता है। यह अभिक्रिया है-
(a) ऊष्मीय वियोजन
(c) ऊष्मीय अपघटन
(b) विस्थापन
(d) अपघटन
उत्तर:
(a) ऊष्मीय वियोजन
2. तप्त निकिल चूर्ण की उपस्थिति में ऐसिटिलीन तथा हाइड्रोजन की अभिक्रिया कहलाती है-
(a) विस्थापन अभिक्रिया
(b) योगात्मक अभिक्रिया
(c) वियोजन अभिक्रिया
(d) अपघटन अभिक्रिया
उत्तर:
(b) योगात्मक अभिक्रिया
3. क्यूप्रिक सल्फेट के विलयन में जब लोहे का टुकड़ा डाला जाता है तो आयरन, कॉपर हटाकर फेरस सल्फेट बनाता है। यह अभिक्रिया है-
(a) प्रतिस्थापन अभिक्रिया
(b) अपघटन अभिक्रिया
(c) योगात्मक अभिक्रिया
(d) वियोजन अभिक्रिया
उत्तर:
(a) प्रतिस्थापन अभिक्रिया
4. निम्नलिखित में ऊष्माशोषी अभिक्रिया है-
(a) H2 + Cl2 → 2HCl + 44.12 किलो कैलोरी
(b) S + O2 → SO2 + 71.0 किलो कैलोरी
(c) C + O2 → CO2 + 94.45 किलो कैलोरी
(d) H2 + I2 → 2Hl – 11.82 किलो कैलोरी
उत्तर:
(d) H2 + I2 → 2Hl – 11.82 किलो कैलोरी
5. निम्नलिखित में ऊष्माक्षेपी अभिक्रिया है-
(a) C + O2 → CO2 + 94.45 किलो कैलोरी
(b) H2 + I2 → 2HI – 11.82 किलो कैलोरी
(c) N2+ + O2 → 2NO – 43.2 किलो कैलोरी
(d) C + 2S → CS2 – 15.4 किलो कैलोरी
उत्तर:
(a) C + O2 → CO2 + 94.45 किलो कैलोरी

6. NH4Cl ⇌ NH4+ + Cl– अभिक्रिया है-
(a) ऊष्मीय अपघटन
(b) आयनिक वियोजन
(c) ऊष्मीय वियोजन
(d) विद्युत् अपघटन
उत्तर:
(c) ऊष्मीय वियोजन
7. निम्नलिखित में योगात्मक अभिक्रिया है-
(a) Zn + H2SO4 → ZnSO4 + H2
(b) 2KBr + Cl2 → 2KCl + Br2
(c) 2H2 + O2 → 2H2O
(d) 2Hgo → 2Hg + O2
उत्तर:
(c) 2H2 + O2 → 2H2O
8. जिन अभिक्रियाओं में आयनों के विनिमय से नये यौगिक बनते हैं, उन्हें कहते हैं-
(a) प्रतिस्थापन अभिक्रिया
(b) उभय अपघटन
(c) योगात्मक अभिक्रिया
(d) वियोजन
उत्तर:
(b) उभय अपघटन
9. निम्न अभिक्रिया में किस पदार्थ का अपचयन हुआ है?
3MnO2 + 4Al → 3Mn + 2AlO3
(a) MnO2
(b) Al
(c) AlO3
(d) Mn
उत्तर:
(a) MnO2
10. निम्न अभिक्रिया एक उदाहरण है-

(a) संयोजन अभिक्रिया
(b) वियोजन अभिक्रिया
(c) विस्थापन अभिक्रिया
(d) द्विविस्थापन अभिक्रिया
उत्तर:
(c) विस्थापन अभिक्रिया
11. अपघटन अभिक्रिया का उदाहरण है-
(a) 2KClO3 → 2KCl (s) + 3O2 (g)
(b) Zn + CuSO4 → ZnSO4 + Cu
(c) Mg + 2HCH → MgCl2+ H2
(d) CaO + H2O → Ca(OH)2
उत्तर:
(a) 2KClO3 → 2KCl (s) + 3O2 (g)
12. लेड (II) नाइट्रेट के घोल (विलयन) में पोटैशियम आयोडाइड का घोल मिलाने पर किस रंग का अवक्षेप प्राप्त होता है?
(a) पीला
(c) लाल
(b) नीला
(d) भूरा
उत्तर:
(a) पीला
13. जब कॉपर सल्फेट के घोल में लोहे की कील या पत्ती डुबोई जाए तो विलयन (घोल) किस रंग का हो जाता है?
(a) नीला
(b) रंगहीन
(c) नाल
(d) हरा
उत्तर:
(d) हरा
14. लेड मल्फेट का रासायनिक सूत्र है-
(a) Pb2SO4
(b) Pb(SO4)2
(c) PbSO4
(d) Pb(SO4)3
उत्तर:
(c) PbSO4
15. निम्नलिखित में से कौन-से ऊष्माशोषी प्रक्रिया हैं?
(i) सल्फ्यूरिक अम्ल का तनुकरण
(ii) शुष्क बर्फ का ऊर्ध्वपातन (सबलिमेशन)
(iii) जनवाप्प का संघनन
(iv) जल का जलवाष्प में बदलना।
(a) (i) और (iii)
(c) केवल (iii)
(b) केवल (ii)
(d) (ii) और (iv)
उत्तर:
(d) (ii) और (iv)
16. दी गई अभिक्रिया, SO2 (g) + 2H2S (g) → 2H2O(g) + 3S(s), में अपचायक (Reducing agent) है-
(a) SO2
(b) H2O
(c) H2S
(d) S
उत्तर:
(c) H2S
17. मीथेन के दहन (Combustion) से प्राप्त होता है-
(a) CO2
(b) H2O
(c) CO2 और H2 O दोनों
(d) CO और H2O दोनों
उत्तर:
(c) CO2 और H2 O दोनों
18. सिल्वर ब्रोमाइड (AgBr) का वियोजन किस ऊर्जा के कारण होता है?
(a) ऊष्मा
(b) प्रकाश
(c) विद्युत
(d) पवन
उत्तर:
(b) प्रकाश

19. दीवारों पर सफेदी करने के दो-तीन दिन बाद चमक आती है-
(a) क्योंकि CaO, H2O से अभिक्रिया कर CO2 बनाता है।
(b) क्योंकि Ca(OH)2, CO2 से अभिक्रिया कर CaCO3 बनाता है।
(c) क्योंकि Ca(OH)2, H2O से अभिक्रिया कर CaCO3 बनाता है।
(d) क्योंकि C, O2 से अभिक्रिया कर CO2 बनाता है।
उत्तर:
(b) क्योंकि Ca(OH)2, CO2 से अभिक्रिया कर CaCO3 बनाता है।
20. निम्नलिखित अभिक्रियाओं में से द्विविस्थापन अभिक्रिया के उदाहरण हैं-
(i) Pb + CuCl2 → PbCl2 + Cu
(ii) Na2SO4 + BaCl2 → BaSO4 + 2NaCl
(iii) C + O2 → CO2
(iv) CH4 + 2O2 → CO2 + 2H2O
(a) (i) और (iv)
(b) केवल (ii)
(c) (i) और (ii)
(d) (iii) और (iv)
उत्तर:
(b) केवल (ii)
रिक्त स्थानों की पूर्ति कीजिए
- ऐसी अभिक्रिया जिसमें दो या दो से अधिक पदार्थ अभिक्रिया करके एक नया पदार्थ बनाते हैं, उसे …………… कहते हैं।
- ऐसी अभिक्रिया जिसमें एक पदार्थ विघटित होकर दो या दो से अधिक सरल पदार्थ बनाता है, …………… कहलाता है।
- जो पदार्थ गलित अवस्था में या विलयन में विद्युत-धारा का वहन करता है, …………… कहलाता है।
- जिन अभिक्रियाओं में ऊष्मा मुक्त होती है, वे अभिक्रियाएँ …………… कहलाती हैं।
- ऐसी अभिक्रिया जिसमें किसी यौगिक में उपस्थित एक तत्त्व दूसरे तत्त्व द्वारा विस्थापित होता है, …………… कहलाता है।
उत्तर:
- संयोजन अभिक्रिया
- विघटन अभिक्रिया
- विद्युत अपघट्य
- उत्क्रमणीय अभिक्रियाएँ
- विस्थापन अभिक्रिया।

![]()
![]()
![]()