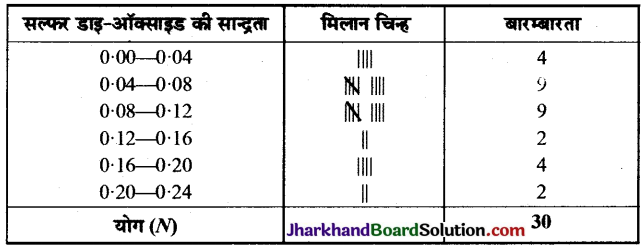
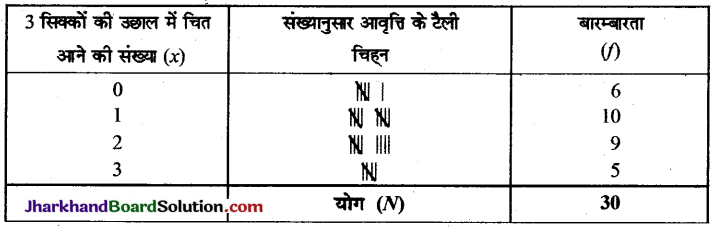
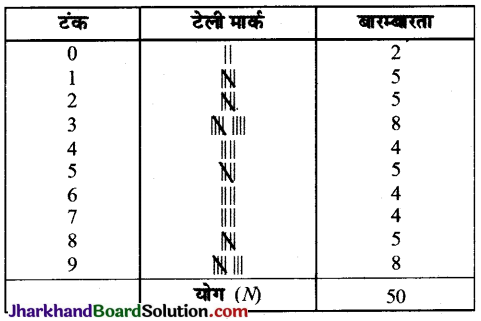
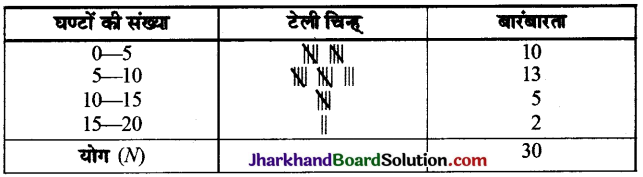
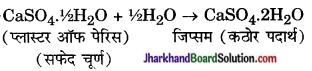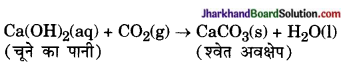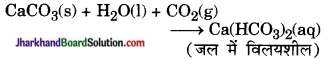Jharkhand Board JAC Class 10 Science Important Questions Chapter 2 अम्ल, क्षारक एवं लवण Important Questions and Answers.
JAC Board Class 10 Science Important Questions Chapter 2 अम्ल, क्षारक एवं लवण
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
निम्नलिखित के आयनिक सूत्र लिखिए-
(a) हाइड्रोजन आयन
(b) हाइड्रॉक्सिल आयन
(c) हाइड्रोनियम आयन।
उत्तर:
(a) हाइड्रोजन आयन H+
(b) हाइड्रॉक्सिल आयन OH–
(c) हाइड्रोनियम आयन H3O+
प्रश्न 2.
उदासीनीकरण क्रिया का आयनिक स्वरूप लिखिए।
उत्तर:
H+ + OH– → H2O
प्रश्न 3.
किसी विलयन का POH मान कितना होगा यदि pH मान 9 हो?
उत्तर:
POH मान = 14 – pH मान
= 14 – 95
= 5
प्रश्न 4.
शुद्ध आसुत जल का pH मान कितना होता है?
उत्तर:
शुद्ध आसुत जल का pH मान = 7

प्रश्न 5.
pH मान को देखकर आप कैसे बता सकते हैं कि कोई विलयन उदासीन / अम्लीय / क्षारीय है?
उत्तर:
यदि pH < 7, विलयन अम्लीय है।
pH = 7, विलयन उदासीन है।
pH > 7 विलयन क्षारीय है।
प्रश्न 6.
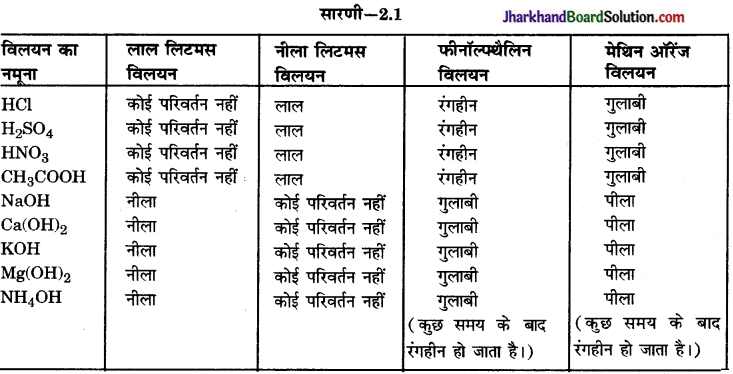
निम्नलिखित सूचकों का रंग कैसा होता है
(i) अम्लीय, (ii) क्षारीय विलयन में-
(a) मेथिल ऑरेन्ज
(b) फिनॉल्फथैलीन
(c) लिटमस पत्र।
उत्तर:
(a) मेथिल ऑरिन्ज- अम्लीय में लाल, क्षारीय में नारंगी – पीला।
(b) फिनॉल्फथैलीन-अम्लीय में रंगहीन, क्षारीय में गुलाबी।
(c) लिटमस पेपर-अम्लीय में नीला, क्षारीय में गुलाबी।
प्रश्न 7.
एक क्रिस्टलीय पदार्थ वायु में खुला रखने पर अपना क्रिस्टल जल छोड़ देता है और सफेद अपारदर्शक पाउडर में परिवर्तित हो जाता है। यह अपारदर्शक पाउडर धोने के काम में आता है। क्रिस्टलीय पदार्थ की पहचान कीजिए।
उत्तर:
वासिंग सोडा (Na2CO3.10H2O)।
प्रश्न 8.
दो प्रबल क्षारकों के नाम बताइए।
उत्तर:
NaOH और KOH।
प्रश्न 9.
दो दुर्बल क्षारकों के नाम लिखिए।
उत्तर:
अमोनियम हाइड्रॉक्साइड (NH4OH) और कैल्सियम हाइड्रॉक्साइड (Ca(OH)2]।
प्रश्न 10.
मिल्क ऑफ मैग्नीशियम क्या है?
उत्तर:
यह एक दुर्बल क्षारक है, जिसका रासायनिक नाम मैग्नीशियम हाइड्रॉक्साइड [Mg(OH)2] है।
प्रश्न 11.
टूथपेस्ट एवं दंत मंजन की प्रकृति क्या होती है?
उत्तर:
इसकी प्रकृति क्षारकीय होती है।
प्रश्न 12.
सोडियम के किसी यौगिक का नाम लिखिए जो ऐन्टैसिड का एक संघटक हो।
उत्तर:
सोडियम हाइड्रोजन कार्बोनेट (NaHCO3)।
प्रश्न 13.
धोने के सोडे के दो उपयोग बताइए।
उत्तर:
- काँच, साबुन एवं कागज उद्योगों में।
- जल की स्थायी कठोरता को हटाने में।

प्रश्न 14.
एक पदार्थ जिसे 373K पर जिप्सम को गर्म करने पर प्राप्त होता है। उस पदार्थ का नाम एवं रासायनिक सूत्र लिखिए।
उत्तर:
कैल्सियम सल्फेट हेमिहाइड्रेट (CaSO4. 1/2H2O)।
प्रश्न 15.
अम्ल एवं धातु कार्बोनेट की अभिक्रिया से कौन-सी गैस उत्सर्जित होती है?
उत्तर:
CO2 गैस।
प्रश्न 16.
धीरे-धीरे कॉपर ऑक्साइड पाउडर में तनु हाइड्रोक्लोरिक अम्ल मिलाने पर प्राप्त घोल का रंग नीला हरा हो जाता है। घोल को नीला हरा रंग प्रदान करने वाले यौगिक का नाम बताइए।
उत्तर:
कॉपर क्लोराइड (CuCl2)।
प्रश्न 17.
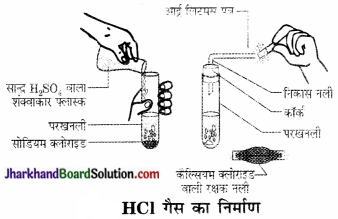
दो प्रबल अम्लों का नाम बताइए।
उत्तर:
HCl एवं H2SO4.
प्रश्न 18.
अम्लों तथा क्षारकों की प्रबलता किस पर निर्भर करती है?
उत्तर:
अम्लों की प्रबलता H+ आयनों की सांद्रता तथा क्षारकों की सांद्रता OH– आयनों की सांद्रता पर निर्भर करती है।
प्रश्न 19.
धावन सोडा का जलीय विलयन अम्लीय है अथवा क्षारीय बताइए।
उत्तर:
क्षारीय।
प्रश्न 20.
शुद्ध जल का pH मान क्या है?
उत्तर:
शुद्ध जल का pH मान 7 है।
प्रश्न 21.
शुद्ध जल के pH मान पर क्या प्रभाव होता है जब उसमें और तेजाब मिलाते हैं?
उत्तर:
जल का pH मान 7 से कम होता जाएगा जैसे-जैसे उसमें तेजाब डाला जाता है।
प्रश्न 22.
22. pH की गणितीय परिभाषा क्या है?
उत्तर:
घोल की हाइड्रोजन आयन की सांद्रता की ऋणात्मक लघुगणक को pH कहते हैं जिसे निम्न समीकरण में प्रकट करते हैं-
pH = – log10[H+] = 10-PH.
प्रश्न 23.
घोल की हाइड्रोजन आयन सांद्रता क्या होगी जब इसका pH मान 4 होगा?
उत्तर:
जब pH मान 4 होगा तो हाइड्रोजन आयन [H+] = 10-4 होगा।
प्रश्न 24.
बेकिंग सोडा का रासायनिक सूत्र लिखिए।
उत्तर:
NaHCO3.

प्रश्न 25.
क्या होता है जब बुझे हुए चूने पर क्लोरीन गैस प्रवाहित की जाती है?
उत्तर:
विरंजक चूर्ण बनता है।

प्रश्न 26.
प्लास्टर ऑफ पेरिस के दो महत्त्वपूर्ण उपयोग लिखिए।
उत्तर:
- शल्य चिकित्सा में टूटी हुई हड्डियों को जोड़ने के लिए।
- खिलौने, मूर्तियाँ आदि बनाने में।
प्रश्न 27.
घावन सोडा का रासायनिक सूत्र लिखें।
उत्तर:
Na2CO3.10H2O.
प्रश्न 28.
सोडियम कार्बोनेट तथा हाइड्रोक्लोरिक अम्ल के बीच अभिक्रिया का समीकरण लिखिए।
उत्तर:
Na2CO3(s) + 2HCl(aq) → 2NaCl(aq) + CO2(g) + H2O(l)
प्रश्न 29.
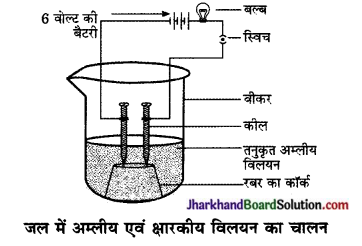
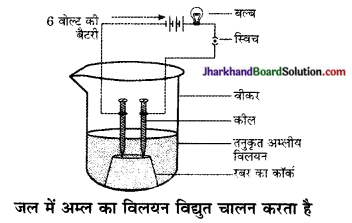
अम्ल का जलीय विलयन क्यों विद्युत का चालन करता है?
उत्तर:
अम्ल का जलीय विलयन हाइड्रोजन आयन (H+ (aq)) उत्पन्न करता है जिसके कारण विद्युत का चालन होता है।
प्रश्न 30.
जिप्सम (CaSO4.2H2O) पर ऊष्मा का प्रभाव दिखाते हुए रासायनिक समीकरण लिखिए।
उत्तर:
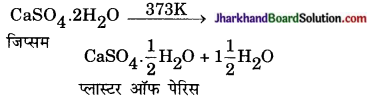
प्रश्न 31.
बेकिंग चूर्ण (पाउडर) के अवयवों के नाम लिखिए।
उत्तर:
बेकिंग पाउडर के दो घटक सोडियम हाइड्रोजन कार्बोनेट और टारटरिक अम्ल या सिट्रिक अम्ल हैं।
लघु उत्तरीय प्रश्न
प्रश्न 1.
निम्नलिखित की आधुनिक परिभाषा लिखिए-
(a) अम्ल
(b) क्षार तथा क्षारक
(c) लवण।
उत्तर:
(a) अम्ल (Acids) – ये ऐसे यौगिक हैं जिनके जलीय विलयन में हाड्रोनियम आयन (H3O+) उपस्थित रहते हैं।
(b) क्षार (Base)- ये ऐसे यौगिक हैं जो जलीय विलयन में उपस्थित H+ आयन से संयोग करके लवण तथा जल (H2O) बनाते हैं।
क्षारक (Alkalis) – ये ऐसे क्षार होते हैं जिनके जलीय विलयन में OH– आयन उपलब्ध होते हैं।
(c) लवण (Salt) – ये ऐसे यौगिक होते हैं जो जलीय विलयन में अथवा पिघली हुई अवस्था में धनात्मक आयन (H+ के अतिरिक्त) तथा ऋणात्मक आयन [(OH–) के अतिरिक्त] में वियोजित हो जाते हैं।
प्रश्न 2.
हाइड्रोनियम (H3O+) आयन कैसे बनता है? आयनिक समीकरण देकर बताइए।
उत्तर:
किसी अम्ल के अणु से मुक्त H+ आयन, जल के अणु से संयोग करके H3O+ आयन बनाता है।
उदाहरणत:
HCl → H+ + cl–
H2O + H+ → H3O+
प्रश्न 3.
‘क्षार’ तथा ‘क्षारक’ में क्या अन्तर है? Na2O क्षारक है परन्तु CuO क्षारक नहीं है। क्यों?
उत्तर:
लघु उत्तरीय प्रश्न संख्या 1 को देखें।
Na2O क्षारक है, क्योंकि जलीय विलयन में यह OH– आयन देता है।
Na2O + H2O → 2Na+ + 2(OH–)
CuO जल में अविलेय है अर्थात् OH– आयन नहीं देता। अतः यह क्षारक नहीं है।
प्रश्न 4.
निम्नलिखित के आयनीकरण की क्रियाएँ लिखिए-
(a) CuSO4, (b) NH4Cl, (c) Ca(OH)2, (d) H3PO4.
उत्तर:
(a) CuSO4 ⇌ Cu2+ + SO42-
(b) NH4Cl ⇌ NH4+ + Cl–
(c) Ca(OH)2 ⇌ Ca++ + 2(OH–)
(d) H3PO4 ⇌ 3H+ + (PO4)3-
प्रश्न 5.
निम्नलिखित की उदासीनीकरण क्रियाओं के समीकरण लिखिए-
(a) Ca(OH)2 तथा HNO3
(b) NH4OH तथा H2SO4
(c) CaO तथा HCl
उत्तर:
(a) Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
(b) 2NHOH + H2SO4 → (NH4)2SO4 + 2H2O
(c) CaO + 2HCl → CaCl2 + H2O

प्रश्न 6.
pH पैमाना क्या नापता है? उदासीन, अम्लीय तथा क्षारीय विलयनों के pH मानों में क्या गुणात्मक अन्तर होता है?
अथवा
हाइड्रोजन आयन सान्द्रण से क्या तात्पर्य है?
उदासीन विलयन में हाइड्रोजन आयन सान्द्रण का मान कितना होता है?
अथवा
PH पैमाना क्या नापता है? उदासीन, अम्लीय तथा क्षारीय विलयनों के pH मान का परास बताइए।
उत्तर:
pH पैमाना किसी अम्ल, क्षार या लवण के विलयन में H+ आयनों की सान्द्रता (मोल / लीटर में) नापता है।
उदाहरणतः यदि विलयन का pH मान 5 है, तो उसमें H+ आयनों की सान्द्रता 1.0 x 10-5 मोल / लीटर होगी।
उदासीन विलयन का pH मान = 7
अम्लीय विलयन का pH < 7 क्षारीय विलयन का pH मान > 7
उदासीन विलयन में H आयन सान्द्रण का मान 1 x 10-7 मोल / लीटर होता है।
प्रश्न 7.
यदि किसी विलयन में [H+] सान्द्रता 1.0 x 10-3 हो तो इसका pH मान कितना होगा तथा विलयन की प्रकृति कैसी (अम्लीय / क्षारीय / उदासीन)
होगी?
उत्तर:
H+ की सान्द्रता = 1.0 x 10-3 मोल/लीटर
∴ pH = [log10 1.0 x 10-3]
= [log10 1.0 + log10 10-3]
= – [0 + (-3)]
= 3
∵ pH का मान 7 से कम है अतः विलयन अम्लीय है।
प्रश्न 8.
एक विलयन का pH मान 5 है। इसमें कितने pH मान का विलयन का समान आयतन मिलाने से विलयन उदासीन हो जायेगा?
उत्तर:
दो विलयनों के मिश्रण के उदासीन होने पर उनका सम्पूर्ण pH मान 7 + 7 = 14 होना चाहिए। अतः यदि एक विलयन का pH मान 5 है तो उसे उदासीन करने के लिए दूसरे विलयन का
pH मान = 14 – 5 = 9
प्रश्न 9.
किन्हीं दो अम्ल-क्षार सूचकों के नाम तथा अम्लीय एवं क्षारीय माध्यम में उनके रंग बताइए।
उत्तर:
- फिनाल्फथैलीन (Phenolpthalein)-अम्ल में रंगहीन, क्षार में गुलाबी।
- मेथिल ऑरेन्ज (Methyl Orange)-अम्ल में लाल, क्षार में नारंगी पीला।
प्रश्न 10.
अम्लों की (a) धातुओं (b) धात्वीय ऑक्साइडों, (c) धात्वीय कार्बोनेटों, (d) धात्वीय सल्फाइटों एवं (e) धात्वीय सल्फाइडों से क्रिया के दो-दो उदाहरण समीकरण सहित दीजिए।
उत्तर:
(a) Zn + 2HCl → ZnCl2 + H2
Fe + H2SO4 → FeSO4 + H2
(b) CaO + H2SO4 → CaSO4 + H2O
ZnO + 2HCl → ZnCl2 + H2O
(c) CaCO3 + H2SO4 → CaSO4 + H2O
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
(d) Na2SO3 + 2HCl → 2NaCl + H2O + SO2
CaSO3 + H2SO4 → CaSO4 + H2O + SO2
(e) FeS + H2SO4 → FeSO4 + H2S
BaS + 2HCl → BaCl2 + H2S
प्रश्न 11.
निम्नलिखित अभिक्रियाओं को संतुलन सहित पूरा कीजिए-
(a) Ca(OH)2 + HCl = ………..
(b) Fe + H2SO4 = ………….
(c) Ca(HCO3)2 + HNO3 = ………..
(d) NH4Cl + Ca(OH)2 = ………..
(e) Cus + H2SO4 = …………
उत्तर:
(a) Ca(OH)2 + 2HCl = CaCl2 + 2H2 O
(b) Fe + H2SO4 = FeSO4 + H2 ↑
(c) Ca(HCO3)2 + 2HNO3 = Ca(NO3)2 + 2H2O + 2CO2
(d) 2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3
(e) CuS + H2SO4 = CuSO4 + H2S
प्रश्न 12.
निम्नलिखित लवणों को वर्गीकृत कीजिए-
NaHCO3; CaS; Cu(OH)NO3;
Na2SO4. Al2(SO4)3
Na3[Fe(CN)6]; Na2HPO4; NaK2PO4
उत्तर:
- NaHCO3 – अम्लीय लवण;
- CaS – सामान्य लवण
- Cu(OH)NO3 – क्षारीय लवणः
- Na2SO4. Al2(SO4)3 – द्विक लवण
- Na3[Fe(CN)6] – जटिल लवण;
- Na2HPO4 – अम्लीय लवण
- NaK2PO4 – मिश्रित लवण।
प्रश्न 13.
निम्नलिखित का अम्ल, क्षार, क्षारक तथा लवण में वर्गीकरण कीजिए-
NH4OH, BaCl2, H3PO4, CaO, Zn(OH)2
उत्तर:
- NH4OH– – क्षारक
- BaCl2 – लवण
- H3PO4 – अम्ल
- CaO – क्षार
- Zn(OH)2 – क्षार
प्रश्न 14.
आयनन है? यह ताप तथा विलयन की सान्द्रता से किस प्रकार प्रभावित होता है?
उत्तर:
लवण का जलीय विलयन में आयनों में वियोजित होना आयनन कहलाता है। ताप बढ़ाने एवं सान्द्रता घटाने पर आयनन बढ़ जाता है।

प्रश्न 15.
हाइड्रोजन आयन सान्द्रण क्या है? उदासीन विलयन में हाइड्रोजन आयन सान्द्रण का मान कितना होगा?
उत्तर:
pH पैमाना किसी अम्ल, क्षार या लवण के विलयन में H+ आयनों की सान्द्रता (मोल / लीटर में) नापता है।
उदाहरणतः यदि विलयन का pH मान 5 है, तो उसमें H+ आयनों की सान्द्रता 1.0 x 10-5 मोल / लीटर होगी।
उदासीन विलयन का pH मान = 7
अम्लीय विलयन का pH < 7 क्षारीय विलयन का pH मान > 7
उदासीन विलयन में H आयन सान्द्रण का मान 1 x 10-7 मोल / लीटर होता है।
प्रश्न 16.
अम्ल व क्षार की आधुनिक धारणा स्पष्ट करें।
अथवा
अम्ल तथा क्षार की आधुनिक परिभाषा लिखिए तथा प्रत्येक को एक उदाहरण द्वारा स्पष्ट कीजिए।
उत्तर:
अम्ल-ये ऐसे यौगिक होते हैं जिनके जलीय विलयन में हाइड्रोनियम आयन (H3O+) उपस्थित होते हैं।
HCl → H+ + Cl–
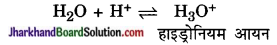
क्षार- क्षार ऐसे यौगिक हैं जो जलीय विलयन में H+ आयन से संयोग करके लवण तथा जल बनाते हैं।
NaOH → Na+ + OH–

प्रश्न 17.
pH की परिभाषा दीजिए। इसका हाइड्रोजन आयन से क्या सम्बन्ध है?
उत्तर:
किसी अम्ल, क्षार या लवण के विलयन में उपस्थित H+ आयनों की सान्द्रता के ऋणात्मक लघुगणक को pH कहते हैं।
PH व हाइड्रोजन आयन में सम्बन्ध किसी विलयन का pH मान विलयन में उपस्थित
pH = log [H+]
किसी विलयन का pH मान विलयन में उपस्थित H+ आयनों के सान्द्रता के ऋणात्मक लघुगणक के बराबर होता है।
प्रश्न 18.
जल का आयनिक गुणनफल क्या है? स्पष्ट करें।
उत्तर:
जल का आयनिक गुणनफल 1 x 10-14 (मोल / लीटर)² होता है।
स्पष्टीकरण – जल का वियोजन निम्नवत् होता है-
H2O ⇌ H++ OH–
जल का आयनिक गुणनफल Kw = [H+][OH–]
जल में [H+] = 1 x 10-7 मोल / लीटर
[OH–] = 1 × 10-7 मोल / लीटर
अतः Kw = 1 x 10-7 x 1 x 10-7
= 1 x 10-14 (मोल / लीटर)²
दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
‘उदासीनीकरण क्रिया को उदाहरण देकर स्पष्ट कीजिए। किसी धातु द्वारा अम्ल से लवण बनाने तथा धात्वीय ऑक्साइड द्वारा अम्ल से लवण बनाने में कौन-सी क्रिया उदासीनीकरण है और कौन-सी नहीं? कारण देकर समझाइए।
उत्तर:
किसी अम्ल एवं क्षार के संयोग से लवण एवं जल बनने की रासायनिक क्रिया को उदासीनीकरण कहते हैं।
उदाहरणतः

वास्तव में अम्ल एवं क्षार के संयोग से H+ तथा OH– आयनों के संयोग से H2O अणु का बनना ही उदासीनीकरण का प्रमुख लक्षण है।
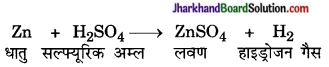
किसी धातु की अम्ल से क्रिया होने पर लवण का बनना उदासीनीकरण नहीं है क्योंकि इस क्रिया में H+ तथा OH– के संयोग से जल H2O नहीं बनता।
उदाहरणतः
परन्तु धात्वीय ऑक्साइड एवं अम्ल के संयोग से लवण बनना उदासीनीकरण है क्योंकि इस क्रिया में H2O अणु बनता है।
उदाहरणत:

प्रश्न 2.
रसोईघर में उपयोग होने वाला बेकिंग सोडा का निर्माण कैसे किया जाता है? खाना पकाते समय इसे गर्म करने पर होने वाली अभिक्रिया का समीकरण दीजिए।
उत्तर:
सोडा का उपयोग रसोईघर में स्वादिष्ट खस्ता पकौड़े बनाने के लिए किया जाता है। कभी-कभी इसका उपयोग खाने को शीघ्रता से पकाने के लिए भी किया जाता है। इस यौगिक का रासायनिक नाम सोडियम हाइड्रोजन कार्बोनेट (NaHCO3) है। कच्चे पदार्थों में सोडियम क्लोराइड का उपयोग कर इसका निर्माण किया जाता है।
NaCl + H2O + CO2 + NH3 →
सोडियम क्लोराइड जल कार्बन डाई ऑक्साइड अमोनिया

खाना पकाते समय इसे गर्म करने पर निम्न अभिक्रिया होती है-
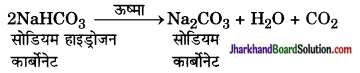
प्रश्न 3.
सोडियम हाइड्रोजन कार्बोनेट के प्रमुख उपयोग बताइए।
उत्तर:
(i) बेकिंग पाउडर बनाने में जो बेकिंग सोडा (सोडियम हाइड्रोजन कार्बोनेट) एवं टार्टरिक अम्ल जैसा एक मंद खाद्य अम्ल का मिश्रण है जब बेकिंग पाउडर को गर्म किया जाता है या जल में मिलाया जाता है तो निम्न अभिक्रिया होती है-

इस अभिक्रिया से उत्पन्न कार्बन डाइऑक्साइड के कारण पावरोटी या केक में खमीर उठ (फूल / उभर) जाता है तथा इससे यह मुलायम एवं स्पंजी हो जाती है।
(ii) सोडियम हाइड्रोजन कार्बोनेट भी ऐन्टैसिड का एक संघटक है। क्षारीय होने के कारण यह पेट में अम्ल की अधिकता को उदासीन करके राहत पहुँचाता है।
(iii) इसका उपयोग सोडा-अम्ल अग्निशामक में भी किया जाता है।
प्रश्न 4.
विरंजक चूर्ण का निर्माण कैसे किया जाता है? इसके कोई दो उपयोग लिखिए।
उत्तर:
जलीय सोडियम क्लोराइड के विद्युत अपघटन से क्लोरीन का निर्माण होता है। इस क्लोरीन गैस का उपयोग विरंजक चूर्ण के उत्पादन के लिए किया जाता है। शुष्क बुझा हुआ चूना [Ca(OH)2] पर क्लोरीन की क्रिया से विरंजक चूर्ण का निर्माण होता है। विरंजक चूर्ण को CaOCl2 से दर्शाया जाता है यद्यपि वास्तविक संगठन काफी जटिल होता है।
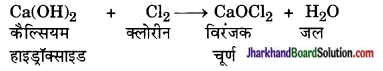
विरंजक चूर्ण का उपयोग-
- वस्त्र उद्योग में सूती एवं लिनेन के विरंजन के लिए, कागज की फैक्ट्री में लकड़ी के मज्जा एवं लाउंड्री में साफ कपड़ों के विरंजन के लिए।
- कई रासायनिक उद्योगों में एक उपचायक के रूप में।
- पीने वाले जल को जीवाणुओं से मुक्त करने और जल की स्थायी कठोरता को हटाने के लिए उपयोग होता है।
प्रश्न 5.
जलीय विलयन में अम्ल या क्षारक किस रूप में रहते हैं? उदाहरण देकर समझाइए।
उत्तर:
जलीय विलयन में अम्ल एवं क्षारक आयनित रूप में रहते हैं। उदाहरण के लिए जल की उपस्थिति में HCl में हाइड्रोजन आयन उत्पन्न होते हैं। जल की अनुपस्थिति में HCl अणुओं से H+ आयन अलग नहीं हो सकते हैं।
HCl + H2O → H3O+ + Cl–
हाइड्रोजन आयन स्वतंत्र रूप में नहीं रह सकते लेकिन ये जल के अणुओं के साथ मिलकर रह सकते हैं। इसलिए
हाइड्रोजन आयन को सदैव H + (aq) या हाइड्रोनियम आयन (HgO+) से दर्शाना चाहिए।
H+ + H2O → H3O+
स्पष्ट है कि अम्ल जल में H3O+ अथवा H+ (aq) आयन प्रदान करता है।
इसी प्रकार क्षार भी जल में (OH–) आयन उत्पन्न करते हैं।
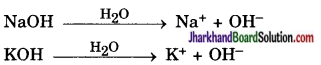
प्रश्न 6.
अम्लों के सामान्य गुणों का विवरण उदाहरण (रासायनिक समीकरणों) सहित कीजिए।
उत्तर:
अम्लों के सामान्य गुण (General Prop-erties of Acids)-
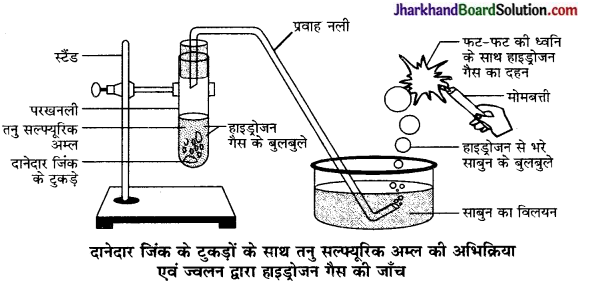
1. सक्रिय धातुओं से क्रिया करके तनु खनिज अम्ल बनाते हैं तथा हाइड्रोजन मुक्त होती है-
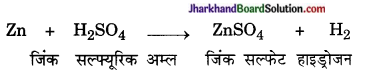
Zn + 2HCl → ZnCl2 + H2 ↑
Fe + H2SO4 → FeSO4 + H2 ↑
HNO3 से क्रिया होने में लवण तो बनता है परन्तु उससे मुक्त हाइड्रोजन HNO3 के तीव्र ऑक्सीकारक होने के कारण, ऑक्सीकृत होकर H2O बनाती है तथा नाइट्रोजन के ऑक्साइड बनते हैं।
2. धात्वीय ऑक्साइडों तथा हाइड्रॉक्साइडों से क्रिया होने पर उदासीनीकरण द्वारा लवण एवं जल बनते हैं-
2NaOH + H2SO4 → Na2SO4 + 2H2O
CuO + 2HCl → CuCl2 + H2O
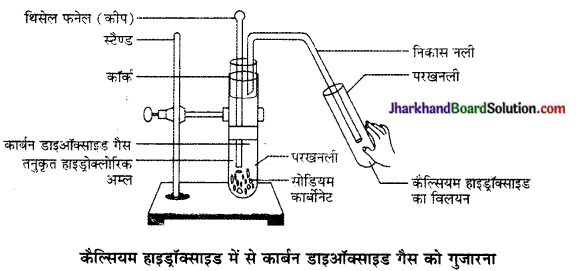
3. धात्वीय कार्बोनेटों एवं हाइड्रोजन कार्बोनेटों से क्रिया होने पर लवण, जल तथा CO2 गैस बनते हैं-
CaCO3 + H2SO4 → CaSO4 + H2O + CO2 NaHCO3 + HCl → NaCl + H2O + CO2
4. धात्त्वीय सल्फाइटों, हाइड्रोजन सल्फाइटों, सल्फाइडों एवं हाइड्रोसल्फाइडों से क्रिया होने पर लवण, जल, SO2 अथवा H2S गैस बनती है।
K2SO3 + 2HCl → 2KCl + H2O + SO2
2NaHSO3 + H2SO4 → Na2SO4 + 2H2O + SO2
ZnS + 2HCl → ZnCl2 + H2S
2KHS + 2HCl → 2KCl + H2S

प्रश्न 7.
क्षारों के सामान्य गुणों का विवरण उदाहरण (रासायनिक समीकरण) सहित कीजिए।
उत्तर:
क्षारों के सामान्य गुण (General Prop-erties of Base) –
1. अम्लों से क्रिया करके लवण तथा जल बनाते है-
CaO + H2SO4 → CaSO4 + H2O
NaOH + HCl → NaCl + H2O
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O
2NH4OH + H2SO4 → (NH4)2SO4 + 2H2O
2. अमोनियम लवणों से क्रिया होने पर लवण, जल तथा अमोनिया गैस बनाती है-
2NH4Cl + Ca(OH)2 → CaCl2 + 2H2O + 2NH3
(NH4)2SO4 + 2NaOH → Na2SO4 + 2H2O + 2NH3
3. सोडियम, पोटैशियम, कैल्सियम तथा अमोनियम हाइड्रॉक्साइडों से अन्य धातुओं के लवणों की क्रिया होने पर धात्वीय हाइड्रॉक्साइडों का प्रक्षेप बनता है।
FeCl3 + 3NaOH → 3NaCl + Fe(OH)3 ↓
CuSO4 + 2KOH → K2SO4 + Cu(OH)2 ↓
ZnCl2 + 2NH4OH → 2NH4Cl + Zn(OH)2 ↓
प्रश्न 8.
(i) क्षारकों की परिभाषा दीजिए।
(ii) इसके तीन गुणधर्म बताइए।
(iii) क्या सभी क्षारक, क्षार होते हैं? आयनिक समीकरण द्वारा स्पष्ट कीजिए।
उत्तर:
(i) धातुओं के हाइड्रॉक्साइड को क्षारक कहते हैं। ये जलीय विलयन में (OH) आयन उत्पन्न करते हैं।
(ii) क्षारकों के गुणधर्म-
- इसका स्वाद कड़वा होता है।
- ये लाल लिटमस पत्र को नीला कर देते हैं।
- ये अम्ल से अभिक्रिया करके लवण तथा जल बनाते हैं, जिसे उदासीनीकरण कहा जाता है।
HCl + NaOH → NaCl + H2O
(iii) नहीं, केवल जल में घुलनशील क्षारक (Base) को क्षार (Alkali) कहते हैं।
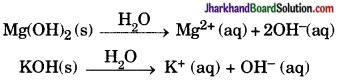
उदाहरण के लिए – Al(OH)3 क्षारक है, परन्तु क्षार नहीं क्योंकि यह जल में अविलेय है।
प्रश्न 9.
(a) केवल जलीय विलयनों से ही विद्युत धारा प्रवाहित होती है। ऐसा क्यों?
(b) अम्लों के तनुकरण पर हाइड्रोनियम आयनों (H3O+) की सांद्रता किस प्रकार परिवर्तित होती है?
(c) विलयनों या तनुकृत विलयनों में से सांद्रित किसका pH मान अधिक होगा?
(d) आप क्या अवलोकन करेंगे?
(i) जब तनु HCl को Na2CO3 में मिलाया जाएगा।
(ii) जब तनु HCl को एक परखनली में रखें Zn पर डाला जाएगा।
उत्तर:
(a) क्योंकि अम्लों के जलीय विलयन में आयन पृथक होते हैं, जो विद्युत धारा के चालन के लिए उत्तरदायी होता है।
(b) तनुकृत करने पर (H3O+) आयनों की सांद्रता घटती है।
(c) तनुकृत अम्लों का pH मान अधिक होगा।
(d) (i) बुदबुदाहट के साथ CO2 गैस निकलती है।
Na2CO3 + 2HCl (dil) → 2NaCl + CO2 + H2O
(ii) रंगहीन एवं गंधहीन H2 गैस के बुलबुले निकलते हैं।
Zn(s) + 2HCl (dil) → ZnCl2 + H2(g)
प्रश्न 10.
उदाहरण देते हुए लवणों का वर्गीकरण समझाइए।
उत्तर:
1. सामान्य लवण (Normal Salt) – इन लवणों के अणु में H+ या (OH)– आयन नहीं होते। ये किसी अम्ल के अणु से H+ आयनों के पूर्ण विस्थापन से बनते हैं, जैसे
CaO + H2SO4 → CaSO4 + H2O
Zn + 2HCl → ZnCl2 + H2
2. अम्लीय लवण (Acidic Salts) – किसी अम्ल के अणु से H+ आयनों के आंशिक विस्थापन से बने लवणों को अम्लीय लवण कहते हैं। इनके अणु में H+ के एकाधिक आयन रहते हैं, जैसे KHSO4, Na2HPO4, KH2PO4 आदि
3. क्षारीय लवण (Basic Salt) – किसी क्षारक (हाइड्रॉक्साइड) के अणु से (OH–) आयनों के आंशिक विस्थापन से क्षारीय लवण बनते हैं। इनके अणु में एकाधिक (OH–) आयन रहते हैं जैसे
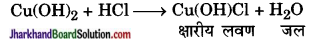
4. द्विक् लवण (Double Salt) – इनके अणु में एक ही प्रकार के अम्लीय आयनों के साथ दो भिन्न क्षारीय आयनों के संयोग से बने अणु होते हैं, जिनमें प्रत्येक अणु एक स्वतन्त्र लवण हो सकता है।
उदाहरणतः
K2SO4Al2(SO4)3.24H2O
(Potassium Ammonium Sulphate or Common Alum)
FeSO4.(NH4)2SO4.6H2O
(Ferrous Ammonium Sulphate or Mohr’s Salt)
ये लवण दो भिन्न लवणों के विलयनों के मिश्रण से क्रिस्टलीकरण करने पर बनते हैं।
5. मिश्रित लवण (Mixed Salt) – ऐसे लवणों के अणु में एक ही अम्लीय या क्षारीय मूलक से दो या दो से अधिक क्षारीय या अम्लीय मूलक संयोग करते हैं।
उदहारणतः
NaKSO4 (Sodium Potassium Sulphate)
Na2KPO4 (Disodium potassium phos-phate)
Ca(OCl) Cl (Calcium chloro hypochlorite or Bleaching powder)
6. जटिल लवण (Complex Salt) – ये द्विक् लवण होते हैं तथा दो सरल लवणों के विलयनों के मिश्रण के क्रिस्टलीकरण से बनते हैं परन्तु विलयन में आयनीकृत होकर एक सरल आयन तथा एक जटिल आयन देते हैं।
उदहारणतः
- K4 [Fe(CN)6] ⇌ 4K+ + [Fe(CN)g]4-
- Na[Ag(CN)2] ⇌ Na+ + [Ag (CN)2]–
सोडियम अर्जेण्टोसायनाइड अर्जेण्टोसायनाइड आयन
आंकिक प्रश्न
प्रश्न 1.
एक विलयन में हाइड्रोजन आयन की सान्द्रता 10-6 M है। इस विलयन का pH मान बताइए। विलयन अम्लीय होगा या क्षारीय।
उत्तर:
हाइड्रोजन आयन सान्द्रता [H+] = 10-6 M
pH = – log [H+]
= – log 10-6
= -(- 6 log 10)
pH = 6
चूँकि pH 7 से कम है अतः विलयन अम्लीय होगा।
प्रश्न 2.
एक विलयन में हाइड्रॉक्साइड आयन सान्द्रण 1 x 108 मोल प्रति लीटर है। इस विलयन का pH मान ज्ञात कीजिए।
उत्तर:
हाइड्रॉक्साइड आयन सान्द्रण [OH–] = 10-8 मोल/लीटर
चूँकि [H+] [OH–] = 10-14
∴ [H+] = \(\frac{10^{-14}}{\left[\mathrm{OH}^{-}\right]}=\frac{10^{-14}}{1 \times 10^{-8}}\) = 10-6
pH = – log H+
= – log 10-6
= (- 6 log 10) = 6
pH = 6
प्रश्न 3.
एक विलयन में हाइड्रॉक्सिल आयन का सान्द्रण 10-11 मोल / लीटर है। विलयन का pH मान ज्ञात कीजिए।
उत्तर:
दिया है [OH–] = 10-11 मोल/लीटर
तो [H+] = 10-3 मोल / लीटर
pH = – log [H+]
= – log 10-3
= 3
pH = 3
प्रश्न 4.
एक विलयन में हाइड्रोजन आयनों की सान्द्रता 10-8 M है। इस विलयन का pH मान बताइए। विलयन अम्लीय है या क्षारीय।
उत्तर:
विलयन में हाइड्रोजन आयनों की सान्द्रता = 10-8 M
pH = – log (H+)
= – log 10-8
चूँकि pH 7 से अधिक है अतः विलयन क्षारीय होगा।

प्रश्न 5.
एक विलयन में हाइड्रोजन आयनों की सान्द्रता 10-9 है। इस विलयन का pH मान परिकलित कीजिए तथा बताइए कि विलयन अम्लीय है या क्षारीय है।
उत्तर:
विलयन में हाइड्रोजन आयनों की सान्द्रता = 10-9 M
pH = – log [H+]
= – log 10-9
= 9
विलयन क्षारीय होगा।
प्रश्न 6.
पोटैशियम हाइड्रॉक्साइड विलयन की सान्द्रता 1 x 10-5 मोल / लीटर है तो इस विलयन का pH मान ज्ञात कीजिए।
उत्तर:
पोटैशियम हाइड्रॉक्साइड आयन सान्द्रण
[OH–] = 1 x 10-5 मोल/लीटर
परन्तु [H+] x [ OH–] = 1 x 10-14
H+ = \(\frac{1 \times 10^{-14}}{1 \times 10^{-5}}\)
= 1 x 10-9
बहुविकल्पीय प्रश्न
निर्देश- प्रत्येक प्रश्न में दिये गये वैकल्पिक उत्तरों में से सही विकल्प चुनिए-
1. उदासीन विलयन के लिए कौन-सा कथन असत्य है-
(a) हाइड्रोजन आयन सान्द्रण का मानं 10-7 मोल / लीटर होता है
(b) हाइड्रॉक्साइड आयन सान्द्रण का मान 10-7 मोल / लीटर होता है।
(c) pH मान 0 होता है
(d) pH मान 7 होता है
उत्तर:
(c) pH मान 0 होता है
2. ऐसीटिक अम्ल में अम्लीय हाइड्रोजन परमाणुओं की संख्या है-
(a) 1
(b) 2
(c) 3
(d) 4
उत्तर:
(a) 1
3. प्रबल अम्ल के जलीय विलयन में किसका आधिक्य होता है?
(a) H+ आयनों का
(b) OH– आयनों का
(c) Cl– आयनों का
(d) Na+ आयनों का
उत्तर:
(a) H+ आयनों का
4. कॉपर सल्फेट विलयन का pH मान होगा-
(a) < 7
(b) 7
(c) > 7
(d) इनमें से कोई नहीं
उत्तर:
(a) < 7
5. निम्न में अम्लीय लवण है-
(a) NaCl
(b) NaHSO4
(c) Na2SO4
(d) KCN
उत्तर:
(b) NaHSO4
6. 10-6 M HCl विलयन का pH मान होगा-
(a) 7
(b) 6
(c) 0
(d) – 6
उत्तर:
(b) 6
7. H2S विलयन का pH मान है-
(a) 0
(b) 7
(c) 7 से कम
(d) 7 से अधिक
उत्तर:
(c) 7 से कम
8. शुद्ध जल का pH मान है-
(a) 0
(b) 1
(c) 7
(d) 14
उत्तर:
(c) 7

9. क्षार जल में विलेय क्षारक होते हैं जो परिवर्तित कर देते हैं-
(a) नीला लिटमस लाल
(b) लाल लिटमस नीला
(c) नीला लिटमस गुलाबी
(d) लाल लिटमस नारंगी
उत्तर:
(b) लाल लिटमस नीला
10. अम्ल तथा क्षारक की परस्पर क्रिया से लवण तथा पानी बनता है। यह क्रिया है-
(a) जल अपघटन
(b) संयोजन
(c) उदासीनीकरण
(d) वैद्युत अपघटन
उत्तर:
(c) उदासीनीकरण
11. किसी विलयन की pH किसकी माप है?
(a) हाइड्रोजन आयन सांद्रता
(b) हाइड्रोनियम आयन सांद्रता
(c) दोनों (a) व (b)
(d) इनमें से कोई नहीं
उत्तर:
(c) दोनों (a) व (b)
12. pH के लिए कौन-सा कथन असत्य है?
(a) pH हाइड्रोजन आयन सांद्रता का मापदंड है
(b) अम्लीय विलयन की pH 7 से कम होती है
(c) pH स्केल में 0-14 तक pH मापी जाती है
(d) क्षारीय विलयन की pH 0-14 होती है।
उत्तर:
(d) क्षारीय विलयन की pH 0-14 होती है।
13. आसुत जल का आयनिक उत्पादक क्या है?
(a) 10-12 मोल / लीटर
(b) 10-7 मोल/लीटर
(c) 10-14 मोल / लीटर
(d) 0.
उत्तर:
(c) 10-14 मोल / लीटर
14. आसुत जल में H + आयन की सांद्रता है-
(a) 10-7 मोल / लीटर
(b) 10-6 मोल/लीटर
(c) 10-4 मोल / लीटर
(d) 100 मोल / लीटर
उत्तर:
(a) 10-7 मोल / लीटर
15. एक घोल का pH मान 4 है तो घोल होगा-
(a) उदासीन
(b) क्षारीय
(c) अम्लीय
(d) आयनिक
उत्तर:
(c) अम्लीय
16. किसी विलयन का pH मान 4 है। इसमें उपस्थित हाइड्रोजन आयन सान्द्रण है-
(a) 1 x 10-4 मोल प्रति लीटर
(b) 1 x 10-7 मोल प्रति लीटर
(c) 1 x 10-14 मोल प्रति लीटर
(d) 1 x 10-8 मोल प्रति लीटर
उत्तर:
(a) 1 x 10-4 मोल प्रति लीटर
17. क्षारीय विलयन में फिनॉल्फ्थलीन / सूचक का रंग होता है-
(a) लाल
(b) पीला
(c) नीला
(d) रंगीन
उत्तर:
(a) लाल

18. अम्लीय विलयन का pH मान है-
(a) 7
(b) 7 से कम
(c) 7 से अधिक
(d) शून्य
उत्तर:
(b) 7 से कम
19. एक विलयन का pH मान 5 है। यह विलयन है-
(a) अम्लीय
(b) क्षारीय
(c) उदासीन
(d) इनमें से कोई नहीं
उत्तर:
(a) अम्लीय
20. निम्नलिखित में दुर्बल अम्ल है-
(a) HCl
(b) HCN
(c) HNO3
(d) H2SO4
उत्तर:
(b) HCN
रिक्त स्थानों की पूर्ति कीजिए-
- जब अम्ल किसी धातु कार्बोनेट या धातु हाइड्रोजन कार्बोनेट से अभिक्रिया करता है तो यह संगत गैस ………………… एवं ………………… उत्पन्न करता है।
- जल में अम्लीय एवं क्षारकीय विलयन विद्युत का चालन करते हैं क्योंकि ये क्रमश: ………………… एवं ………………… आयन का निर्माण करते हैं।
- अम्ल या क्षारक की प्रबलता की जाँच ………………… स्केल के उपयोग से की जा सकती है जो विलयन में हाइड्रोजन आयन की सांद्रता की माप होता है।
- विलयन में H+ (aq) आयन के निर्माण के कारण ही पदार्थ की प्रकृति ………………… होती है। विलयन में OH– (aq) आयन के निर्माण से पदार्थ की प्रकृति होती है।
- जब कोई अम्ल किसी धातु के साथ अभिक्रिया करता है तो ……………….. गैस का उत्सर्जन होता है। साथ ही संगत ………………… का निर्माण होता है।
- जब क्षारक किसी धातु से अभिक्रिया करता है तो ………………… गैस के उत्सर्जन के साथ एक ………………… का निर्माण होता है जिसका ऋण आयन एक धातु एवं ऑक्सीजन के परमाणुओं से संयुक्त रूप से निर्मित होता है।
उत्तर:
- लवण, कार्बन डाइऑक्साइड, जल
- हाइड्रोजन, हाइड्रॉक्साइड
- pH
- अम्लीय क्षारीय
- हाइड्रोजन, लवण
- हाइड्रोजन, लवण।
![]()
![]()


![]()

![]()