Jharkhand Board JAC Class 10 Science Important Questions Chapter 3 धातु एवं अधातु Important Questions and Answers.
JAC Board Class 10 Science Important Questions Chapter 3 धातु एवं अधातु
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
संक्षारण क्या है?
उत्तर:
संक्षारण – वायु या रासायनिक पदार्थों द्वारा धातुओं का धीरे-धीरे क्षय होना संक्षारण कहलाता है।
प्रश्न 2.
गालक किसे कहते हैं?
उत्तर:
अयस्क का प्रगलन करते समय अयस्क में उपस्थित गलनीय अपद्रव्यों को दूर करने के लिए मिलाये जाने वाले पदार्थ को गालक कहते हैं।
प्रश्न 3.
निस्तापन को परिभाषित करो।
उत्तर:
सान्द्रित अयस्क को वायु की अनुपस्थिति में पिघलने से पूर्व तक गर्म करना निस्तापन कहलाता है।
प्रश्न 4.
मिश्रधातु क्या है?
उत्तर:
दो या दो से अधिक धातुओं को पिघलाकर ठण्डा करने से जो समांग धातु मिश्रण मिलता है, उसे मिश्रधातु कहते हैं।
![]()
प्रश्न 5.
आयरन के प्रमुख अयस्क का सूत्र लिखो।
उत्तर:
आयरन का प्रमुख अयस्क है-
हेमेटाइट – Fe2O3
प्रश्न 6.
ऐलुमिनियम के प्रमुख अयस्क का सूत्र लिखिए-
उत्तर:
एल्युमिनियम के प्रमुख अयस्क हैं-
बॉक्साइट-Al2O3.2H2O
प्रश्न 7.
धातुकर्म क्या है?
उत्तर:
अयस्क से शुद्ध धातु प्राप्त करने की क्रिया को धातुकर्म कहते हैं।
प्रश्न 8.
भर्जन से क्या समझते हो?
उत्तर:
सान्द्रित अयस्क को वायु या ऑक्सीजन की उपस्थिति में भट्टी में गलनांक से नीचे गर्म किया जाता है। इस क्रिया को भर्जन कहते हैं।
प्रश्न 9.
धातु संक्षारण क्या है?
उत्तर:
धातु संक्षारण – धातुओं की नष्ट होने की एक ऐसी धीमी प्रक्रिया जिसमें वायुमण्डल की नमी की उपस्थिति में धातुएँ ऑक्सीजन से क्रिया करके भंगुर ऑक्साइड तथा हाइड्रॉक्साइड बना देती हैं। इसमें धातु की सतह परत के रूप में उखड़ती रहती है। यही धातु संक्षारण है।
प्रश्न 10.
धातुमल क्या है?
उत्तर:
प्रगलन की प्रक्रिया में गालक पदार्थ अशुद्धियों से मिलकर कम गलनांक वाले जो गलनीय पदार्थ बनाते हैं वे धातुमल कहलाते हैं। लोहे के प्रगलन में कैल्सियम सिलिकेट (CaSiO3) नामक धातुमल बनते हैं।
प्रश्न 11.
किसी एक धातुमल का सूत्र लिखिए।
उत्तर:
लोहे के धातुकर्म में प्राप्त धातुमल हैं- कैल्सियम सिलिकेट – (CaSiO3)।
प्रश्न 12.
आघातवर्ध्यता ‘क्या तात्पर्य है?
उत्तर:
किसी पदार्थ के हथौड़े से पीटने पर पतली चादर में परिवर्तित हो जाने के गुण को आघातवर्ध्यता कहते हैं। धातुएँ आघातवर्ध्य होती हैं।
प्रश्न 13.
दो अत्यधिक आघातवर्ध्य धातुओं के नाम लिखिए।
उत्तर:
सोना तथा चाँदी अत्यधिक आघातवर्ध्य धातुएँ हैं।
प्रश्न 14.
प्राचीन काल में मानव को ज्ञात धातुओं के नाम बताइए।
उत्तर:
प्राचीन काल में मानव को सोना, चाँदी, ताँबा, टिन, लोहा, सीसा, पारा तथा एंटीमनी का ज्ञान था।
प्रश्न 15.
कौन-सी धातु सामान्य ताप पर तरल (द्रव्य) होती है?
उत्तर:
पारा (Hg)।
प्रश्न 16.
विद्युत अपघटनी परिष्करण द्वारा किये जाने वाले तीन धातुओं के नाम लिखिए।
उत्तर:
- ताँबा (Cu)
- चाँदी (Ag)
- टिन (Sn)।
प्रश्न 17.
कौन सी धातु सल्फाइड अपने ऑक्साइड के साथ संयुक्त होकर धातु बनाता है? अभिक्रियाएँ लिखिए।
उत्तर:
ताँबा,
Cu2S + 2Cu2O → 6Cu + SO2↑
![]()
प्रश्न 18.
उन धातु- ऑक्साइडों के नाम बताइए जो कार्बन के साथ गर्म किए जाने पर धात्विक अवस्था में अपचयित नहीं होते हैं।
उत्तर:
Cr2O3, Mn3O4.
प्रश्न 19.
निस्तापन और भर्जन में अंतर बताइए।
उत्तर:
हवा की सीमित सप्लाई में अयस्क को गलन से ताप तक गर्म करके उसमें से नमी और वाष्पशील पदार्थों को अलग करना निस्तापन कहलाता है। हवा की मुक्त सप्लाई में अयस्क को गलन से कम ताप पर गर्म करके ऑक्सीकृत करना भर्जन कहलाता है।
प्रश्न 20.
एक-एक ऐसी धातुओं के उदाहरण-
- कक्ष के ताप पर द्रव होती है
- चाकू द्वारा सुगमतापूर्वक काटी जा सकती है,
- ऊष्मा की सर्वोत्तम चालक होती है,
- ऊष्मा की अल्पतम चालक होती है।
उत्तर:
- मरकरी (Hg)
- सोडियम (Na)
- सिल्वर (Ag)
- लेड (Ph)।
प्रश्न 21.
शुद्ध सोना कितने कैरट का होता है?
उत्तर:
24 कैरेट का।
प्रश्न 22.
सिनाबार क्या है?
उत्तर:
सिनाबार लैड (सीसा) का एक अयस्क होता है, जिसका सूत्र HgS है।
प्रश्न 23.
एक द्रव धातु तथा अधातु का नाम लिखिए।
उत्तर:
- द्रव धातु-पारा (Hg)।
- द्रव अधातु – ब्रोमीन (Br)।
प्रश्न 24.
किन्हीं ऐसी दो अधातुओं के नाम लिखिए जिनमें भंगुरता तथा तन्यता दोनों गुण हों।
उत्तर:
कार्बन तथा फॉस्फोरस।
प्रश्न 25.
गैल्वनीकरण का क्या अर्थ है?
उत्तर:
लोहे से बनी वस्तुओं पर जिंक की एक पतली परत चढ़ाने की प्रक्रिया को गैल्वनीकरण कहते हैं।
प्रश्न 26.
मूर्तियाँ बनाने के लिए सामान्यतः किस धातु का उपयो ‘उपयोग होता है?
उत्तर:
काँसा (ताँबा टिन)।
प्रश्न 27.
एक ऐसी अधातु का नाम बताइए जो विद्युत की सुचालक है।
उत्तर:
कार्बन (ग्रेफाइट) एक ऐसी अधातु है जो विद्युत की सुचालक है।
प्रश्न 28.
अधातुओं के ऑक्साइडों की प्रकृति अम्लीय होती है या क्षारीय?
उत्तर:
अधातुओं के ऑक्साइड सामान्यतः अम्लीय प्रकृति के होते हैं।
प्रश्न 29.
अधातुएँ सामान्यतः कैसे आयन बनाती हैं?
उत्तर:
अधातुएँ सामान्यत: इलेक्ट्रॉन ग्रहण करके ऋण आवेशित ऋणायन (Anion) बनाती हैं। जैसे-
Cl + e– → Cl–
प्रश्न 30.
धातु अपचायक तथा अधातु उपचायक क्यों हैं?
उत्तर:
धातु अपचायक होती हैं क्योंकि यह इलेक्ट्रॉन खोकर धनात्मक आयन बनाती हैं। अधातु उपचायक होती हैं। क्योंकि यह इलेक्ट्रॉन ग्रहण कर ऋणात्मक आयन बनाती हैं।
प्रश्न 31.
पानी संग्रहण के लिए सीसे या लेड के उपयुक्त हैं?
उत्तर:
वायु की उपस्थिति में सीसा (Pb) तथा पानी की क्रिया से एक विषैला पदार्थ लेड हाइड्रॉक्साइड [Pb(OH)2) बनता है इसलिए सीसे या लेड के पात्र पानी संग्रहण के लिए उपयुक्त नहीं हैं।
प्रश्न 32.
ताँबे की छड़ को सिल्वर नाइट्रेट (AgNO3) के घोल में डुबाने पर क्या होगा?
उत्तर:
विलयन का रंग नीला हो जाएगा। ताँबा सिल्वर नाइट्रेट विलयन में से सिल्वर को विस्थापित कर देता है अतः ताँबा सिल्वर से अधिक सक्रिय है।
लघु उत्तरीय प्रश्न
प्रश्न 1.
ऐलुमिनियम का शोधन करने की किसी एक विधि का वर्णन कीजिए।
उत्तर:
ऐलुमिनियम का शोधन ( Refining of Aluminium) – ऐलुमिनियम धातु का शोधन हूप प्रक्रम (Hoope’s Process) द्वारा किया जाता है।
ऐलुमिनियम धातु का शोधन करने के लिए लोहे का पात्र लेते हैं, जिसकी पेंदी ( bottom) पर Cu तथा Al की का अस्तर (coating) लगा होता है, जो ऐनोड मिश्रधातु का का कार्य करता है। ग्रेफाइट की प्लेटें कैथोड का कार्य करती हैं। विद्युत अपघट्य (electrolyte) के स रूप में पिघले हुए पदार्थों की तीन परतें (layers) होती हैं। सबसे नीचे वाली परत में अशुद्ध ऐलुमिनियम होता है जिसमें सिलिका आदि की अशुद्धियाँ रहती हैं। बीच वाले भाग ऐलुमिनियम, सोडियम तथा बेरियम के फ्लोराइडों तथा ऐलुमिना (AlgOg) का मिश्रण होता है। सबसे ऊपर की परत (layer) में शुद्ध ऐलुमिनियम होता है जो कैथोड के सम्पर्क में रहता है।
विद्युत धारा प्रवाहित करने पर बीच वाली परत (layer) का शुद्ध ऐलुमिनियम सबसे ऊपर वाली परत में आ जाता है तथा सबसे नीचे वाली परत (layer) से उतना ही ऐलुमिनियम बीच वाली परत में चला जाता है। यह क्रम चलता रहता है और शुद्ध ऐलुमिनियम सबसे ऊपरी भाग में एकत्रित होता रहता है, जिसे निकास द्वार से निकाला जाता है, जैसा कि चित्र में दिखाया गया है।
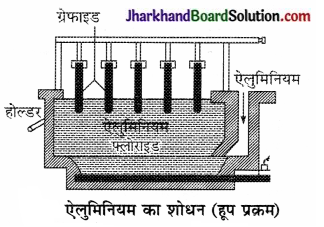
उपर्युक्त विधि से 99.9% शुद्ध ऐलुमिनियम धातु प्राप्त होती है।
प्रश्न 2.
खनिज, अयस्क मिश्रधातु तथा गालक को स्पष्ट कीजिए।
अथवा
गालक से आप क्या समझते हैं? किसी एक अम्लीय गालक की क्रिया को केवल रासायनिक समीकरण द्वारा स्पष्ट कीजिए।
उत्तर:
खनिज – धातुओं के ये यौगिक पृथ्वी की ऊपरी पर्त में बालू मिट्टी तथा अन्य अशुद्धियों से मिश्रित रूप में प्राप्त होते हैं। इन्हें खनिज कहते हैं जिनमें कुछ वाले तथा अन्य विविध संघटन वाले समांगी ठोस होते हैं।
अयस्क – अयस्क वह खनिज पदार्थ होता है जिससे धातु का निष्कर्षण सरलता से कम खर्च में एवं अधिक मात्रा में होता है। प्रायः ऑक्साइड, सल्फाइड तथा कार्बोनेट खनिज अयस्क होते हैं।
मिश्रधातु – दो या दो से अधिक धातुओं को पिघलाकर एक निश्चित अनुपात मिलाने पर एक समांगी मिश्रण प्राप्त होता है जिसे मिश्रधातु कहते हैं।
गालक – ये वे पदार्थ हैं जो धातु में विद्यमान अगलनीय अशुद्धियों को पृथक करने में प्रयुक्त होते हैं। ये दो प्रकार के होते हैं-
![]()
- अम्लीय गालक जैसे SiO2
- क्षारीय गालक जैसे CaO।
प्रश्न 3.
शुद्ध सोना 24 कैरेट का होता है, परंतु आभूषण बनाने के लिए इसमें प्रायः 2 भाग ताँबा या चाँदी क्यों मिलाया जाता है?
उत्तर:
क्योंकि 24 कैरेट का सोना काफी नर्म होता है इसलिए है। इसे कठोर बनाने के लिए इसमें 2 भाग Cu या Ag आभूषण बनाने के लिए यह उपयुक्त नहीं होता मिलाया जाता है। इसलिए भारत में ज्यादातर 22 कैरेट के निर्माण में सोने का उपयोग आभूषण बनाने में होता है।
![]()
प्रश्न 4.
खाना पकाने वाले बर्तनों कॉपर की अपेक्षा ऐलुमिनियम के मिश्र धातु उपयोग में लाए जाते हैं। ऐसा क्यों? दो कारण बताइए।
उत्तर:
निम्नलिखित दो कारणों से ऐलुमिनियम के मिश्र धातुओं के बर्तनों का उपयोग खाना बनाने वाले बर्तनों के लिए होता है-
- यह खाद्य पदार्थों में मौजूद अम्लों से अभिक्रिया नहीं करता है।
- यह कॉपर की अपेक्षा हल्का होता है।
प्रश्न 5.
क्या होता है जब लोहे की कील को कॉपर सल्फेट के विलयन में डुबोकर रखा जाता है?
उत्तर:
कॉपर सल्फेट का नीला रंग हल्का हो जाता है, क्योंकि कॉपर धातु को आयरन (Fe) विस्थापित कर FeSO4 बनाता है। लोहे की कील पर लाल भूरे रंग की कॉपर की परत दिखाई देती है।
CuSO4(aq) + Fe(s) → FeSO4(aq) + Cu(s)
प्रश्न 6.
अधिकांश धातुएँ क्षारकों से अभिक्रिया नहीं करती हैं, पर जिंक क्षारकों से अभिक्रिया करती है। इसका एक कारण लिखिए।
उत्तर:
जिंक क्षारकों से अभिक्रिया इसलिए करती है क्योंकि यह एक उभयधर्मी प्रकृति के तत्त्व हैं।
![]()
प्रश्न 7.
ताँबे के चार उपयोग लिखो।
उत्तर:
- यह विद्युत ‘सुचालक है। अतः विद्युत संघनित्र बनाने में उपयोग किया जाता है।
- विद्युत लेपन में इसका उपयोग किया जाता है।
- कैलोरीमीटर तथा निवांत पात्र बनाने के काम आता है।
- ताँबे की मिश्रधातुओं का सिक्के, बर्तन, फूलदान, लॅप तथा अन्य सजावटी सामान बनाने में उपयोग होता है
प्रश्न 8.
उस रासायनिक अभिक्रिया का समीकरण लिखिए जो सोडियम के टुकड़े को पानी में डालने पर होती है। लाल लिटमस कागज का रंग कैसा हो जाएगा यदि उसे उपर्युक्त अभिक्रिया से प्राप्त विलयन में डाला
जाए?
उत्तर:
अभिक्रिया का समीकरण – 2Na + 2H2O → 2NaOH + H2
अभिक्रिया प्रचंड होती है। इससे प्राप्त विलयन, सोडियम हाइड्रॉक्साइड के कारण क्षारीय (Alkaline) होता है। अतः इसमें डाला गया लाल लिटमस कागज नीला हो जाएगा।
प्रश्न 9.
क्या होता है जब- (i) कॉपर ऑक्साइड को मैग्नीशियम के साथ गर्म किया जाता है?
(ii) ऐलुमिनियम की तार को उबलते पानी में डुबोया जाता है?
(iii) गर्म लोहे पर से भाप गुजारी जाती है?
उत्तर:
(i) मैग्नीशियम के साथ गर्म करने पर कॉपर ऑक्साइड, कॉपर धातु में अपचयित हो जाता है।
CuO + Mg → MgO + Cu
(ii) उबलते हुए पानी में ऐलुमिनियम की तार को डालने से ऐलुमिनियम, हाइड्रोजन मुक्त करता है तथा ऐलुमिनियम हाइड्रॉक्साइड बन जाता है।
2Al + 3H2O(g) → Al2O3 (s) + 3H2
(iii) 3Fe(s) + 4H2O(g) → Fe3O4 (s) + 4H2(g)
प्रश्न 10.
अति चालकता से क्या तात्पर्य है? यह गुण कितनी धातुओं में पाया जाता है?
उत्तर:
एच. कामरलिंग ओनेस के अनुसार निम्न ताप (- 269°C) पर पारे का प्रतिरोध खत्म हो जाता है। इस कारण धातुओं की चालकता बढ़ जाती है। धातुओं के इस गुण को अति चालकता कहते हैं।
प्रश्न 11.
निम्न अभिक्रियाओं की रासायनिक समीकरण लिखिए-
(a) आयरन की भाप के साथ,
(b) कैल्सियम की जल के साथ,
(c) पोटैशियम की जल के साथ,
(d) जिंक की HCl के साथ,
(e) आयरन की HCI के साथ।
उत्तर:

प्रश्न 12.
धातुओं की (i) ऑक्सीजन तथा (ii) तनु अम्लों से क्रिया का वर्णन कीजिए।
उत्तर:
(i) ऑक्सीजन से अभिक्रिया – बहुत-सी धातुएँ ऑक्सीजन या वायु से अभिक्रिया करती हैं तथा उनके ऑक्साइड बनते हैं। ये ऑक्साइड स्वभाव से क्षारीय होते हैं तथा पानी में में घुलकर क्षार बनाते हैं जैसे- सोडियम ऑक्सीजन से अभिक्रिया करके सोडियम ऑक्साइड (Na2O) बनाती है। यह एक क्षारीय ऑक्साइड है तथा
पानी में घुलकर सोडियम हाइड्रॉक्साइड बनाता है।
4Na + O2 → 2Na2O
Na2O + H2O → 2NaOH
मैग्नीशियम को जब वायु में उसके ज्वलन ताप तक गर्म किया जाता है, तो वह जलने लगता है तथा जलकर मैग्नीशियम ऑक्साइड बनाता है।
2Mg + O2 → 2MgO
लोहा (Fe) तथा ताँबा (Cu) कम क्रियाशील हैं तथा अधिक देर तक ऑक्सीजन में गर्म करने पर अभिक्रिया करते हैं।
4Fe + 3O2 → 2FeO3
2Cu + Og → 2CuO
(ii) तनु अम्लों से अभिक्रिया – बहुत सी धातुएँ तनु अम्लों से अभिक्रिया करके धात्विक लवण तथा हाइड्रोजन बनाती हैं। हाइड्रोजन के बुदबुदाहट (Effervescence) की दर धातु की अभिक्रियाशीलता पर निर्भर करती है। बुदबुदाहट की उच्च दर का अर्थ है- धातु की उच्च क्रियाशीलता।
2Na + 2HCl → 2NaCl + H2
Mg + 2HCl → MgCl2 + H2
Zn + 2HCl → ZnClgs + H2
Fe + 2HCl → FeCl2 + H2
प्रश्न 13.
धातु संक्षारण से आप क्या समझते हैं? इससे किस प्रकार हानि होती है?
उत्तर:
अधिकांश धातुएँ जो क्रियाशील होती हैं वे सभी वायुमण्डल में खुले छोड़ने पर वायु (ऑक्सीजन), नमी (जल), CO2, SO2 आदि से अभिक्रिया कर यौगिकों में बदल जाती हैं। ये प्राप्त यौगिक भंगुर होते हैं और धातु की सतह से अलग होते रहते हैं। इस प्रकार धातु का वायुमंडल के अभिकर्मकों द्वारा यौगिकों में बदलकर नष्ट होना संक्षारण कहलाता है। लोहे की वस्तुओं में जो यौगिक बनता है, उसका रंग लाल या नारंगी होता है, इसे जंग कहते हैं। इसका सूत्र Fe2O3. x H2O है।
हानि-संक्षारण की अभिक्रिया के दौरान प्राप्त भंगुर यौगिक की धातु पर परत बन जाती है जो धीरे-धीरे धातु सतह से अलग हो जाता है।
![]()
प्रश्न 14.
उपधातु किसे कहते हैं?
उत्तर:
वे पदार्थ जो धातुओं और अधातुओं दोनों के गुण प्रदर्शित करते हैं, उपधातु कहलाते हैं। उपलब्ध सात उपधातु निम्नलिखित हैं-
एंटीमनी (Sb), पोलोनियम (Po), सिलिकॉन (Si), बोरॉन (B), जर्मेनियम (Ge), टेलुरियम (Te), आर्सेनिक (As)।
प्रश्न 15.
प्रकृति में धातुएँ किस अवस्था पायी जाती हैं?
उत्तर:
प्रकृति में धातुएँ निम्न दो अवस्थाओं में पायी जाती हैं-
(1) मुक्त अवस्था में कम अभिक्रियाशील धातुएँ प्रकृति में धात्विक या स्वतंत्र अवस्था में पायी जाती हैं। जैसे सोना, चाँदी, प्लेटिनम आदि।
(2) संयुक्त अवस्था में सामान्य रूप से अभिक्रियाशील धातुएँ प्रकृति में संयुक्त अवस्था में विभिन्न यौगिकों के रूप में पायी जाती हैं। धातुओं के ये यौगिक निम्न प्रकार हैं-
- सल्फाइड
- ऑक्साइड
- कार्बोनेट
- हैलाइड।
प्रश्न 16.
जब कॉपर (II) सल्फेट के दानों को सांद्र H2SO4 में रखा जाता है तो क्या होता है? आपने क्या देखा व्याख्या करें।
उत्तर:
एक परखनली में कॉपर (II) सल्फेट के कुछ दाने डालो और उसमें सांद्र सल्फ्यूरिक अम्ल की कुछ बूँदें डालो। आप देखेंगे कि कॉपर (II) सल्फेट का नीला रंग धीरे-धीरे सफेद हो जाता ऐसा सल्फ्यूरिक अम्ल द्वारा जल के अणु निकालने से होता है। एनहाइड्स लवण सफेद रंग का होता है।

प्रश्न 17.
कारण बताओ-
(i) धातु तनु अम्ल से हाइड्रोजन को विस्थापित कर देती है जबकि अधातुएँ नहीं।
(ii) कार्बोनेट और सल्फाइड अयस्कों को आमतौर पर ऑक्साइड में परिवर्तित कर दिया जाता है।
उत्तर:
(i) क्योंकि धातुओं में मुक्त इलेक्ट्रॉन होते हैं। धातुएँ हाइड्रोजन को आसानी से इलेक्ट्रॉन दे सकती हैं जबकि अधातुओं में मुक्त इलेक्ट्रॉन नहीं होते। ये हाइड्रोजन ‘नहीं दे सकतीं।
(ii) कुछ धातुओं को उनके सल्फाइडों या कार्बोनिटों की तुलना में उनके ऑक्साइडों से प्राप्त करना अधिक सरल है। इसलिए सल्फाइड एवं कार्बोनेट अयस्कों को वायु में भर्जित करके ऑक्साइडों में परिवर्तित कर दिया जाता है।
प्रश्न 18.
विद्युत रासायनिक श्रेणी की सहायता से धातुओं द्वारा अम्लों से विस्थापित करने की क्षमता किस प्रकार ज्ञात करते हैं? उदाहरण सहित स्पष्ट कीजिए।
उत्तर:
विद्युत रासायनिक श्रेणी में हाइड्रोजन के ऊपर की धातुएँ अम्लों से H2 विस्थापित करती हैं। जैसे- सोडियम (Na), मैग्नीशियम (Mg) आदि।
प्रश्न 19.
रासायनिक दृष्टिकोण से धातु तथा अधातु में मुख्य अन्तर क्या हैं?
उत्तर:
भौतिक एवं रासायनिक दृष्टिकोण से धातु तथा अधातु में प्रमुख अन्तर निम्नलिखित हैं-
भौतिक गुण (Physical Properties):
| धातु (Metal) | अधातु (Non-metal) |
| 1. अवस्था-धातु सामान्यतया ठोस होते हैं, जैसे-लोहा, ताँबा, सोडियम (पारे को छोड़कर) । उनमें आघातवर्ध्यता और तार में खिंचने के गुण होते हैं। | 1. अधातु ठोस, द्रव और गैस तीनों अवस्थाओं में होते हैं। जैसे-गंधक ठोस, ब्रोमीन द्रव और ऑक्सीजन गैस है। अधातु ठोस भंगुर होते हैं। |
| 2. पारदर्शिता-धातु अपारदर्शी होते हैं। | 2. कुछ अधातु पारदर्शी (जैसे गैसें), कुछ अपारदर्शी तथा कुछ पारभासी होते हैं। |
| 3. घनत्व तथा गलनांक-धातु (सोडियम एवं पोटैशियम को छोड़कर) अधिक घनत्व एवं उच्च गलनांक के होते हैं। | 3. अधातुओं का घनत्व तथा गलनांक प्राय: कम होता है। |
| 4. चमक-धातुओं में विशेष चमक होती है जिसे धात्वीय चमक (metallic lustre) कहते हैं। | 4. ग्रेफाइट, हीरा और आयोडीन के अतिरिक्त अन्य अधातुओं में कोई विशेष चमक नही होती है। |
| 5. चालकता-सभी धातु ऊष्मा एवं विद्युत के सुचालक होते हैं। | 5. ग्रेफाइट तथा गैस कार्बन के अतिरिक्त अधातु ऊष्मा और विद्युत के कुचालक होते हैं। |
| 6. ध्वनि-किसी कठोर वस्तु से टकराने पर धातुओं से धात्विक ध्वनि (metallic sound) उत्पन्न होती है। | 6. अधातु कोई विशेष ध्वनि उत्पन्न नहीं करते। |
रासायनिक गुण (Chemical Properties):
| धातु (Metal) | अधातु (Non-metal) |
| 1. क्षारीय प्रकृति-धातुओं के ऑक्साइड क्षारीय (basic) होते हैं। परन्तु ऐलुमिनियम, जिंक तथा टिन के ऑक्साइड उभयधर्मी होते हैं। | 1. अधातुओं के ऑक्साइड अम्लीय (acidic) होते हैं-परन्तु हाइड्रोजन के ऑक्साइड एवं कार्बन मोनो ऑक्साइड उदासीन होते हैं। |
| 2. अम्लों से क्रिया-कुछ धातुएँ अम्लों से क्रिया करके हाइड्रोजन को विस्थापित करती हैं तथा लवण बनाती है। | 2. अधातुएँ अम्लों से हाइड्रोजन विस्थापित नहीं करती एवं लवण नहीं बनाती। |
| 3. हाइड्रोजन से संयोग-अधिकांश धातुएँ हाइड्रोजन से संयोग नहीं करतीं। कुछ धातुएँ (जैसे लीधियम, सोडियम तथा पोटैशियम, हाइड्रोजन से संयोग करके अस्थायी यौगिक बनाती हैं। | 3. अधातुएँ हाइड्रोजन से संयोग करके स्थायी यौगिक बनाती हैं, जैसे मेथेन (CH<sub>4</sub>), अमोनिया (NH<sub>3</sub>), फॉस्फीन (PH<sub>3</sub>), हाइड्रोजन क्लोराइड (HCl) आदि। |
| 4. विद्युतीय प्रकृति-धातुएँ धन-विद्युती होने के कारण विद्युत्-अपघटन करने पर कैथोड पर एकत्र होती हैं। | 4. अधातुएँ हाइड्रोजन के अतिरिक्त ऋण-विद्युती होने के कारण विद्युत् अपघटन करने पर ऐनोड पर एकत्र होती हैं। |
| 5. मिश्रधातु-कुछ धातुएँ अन्य धातुओं से मिलकर मिश्र धातु (alloys) बनाती हैं। जैसे-पीतल, काँसा आदि। | 5. अधातुएँ मिश्र धातु नहीं बनार्ती। |
प्रश्न 20.
निम्नलिखित में अन्तर कीजिए-
(i) खनिज तथा अयस्क
(ii) निस्तापन तथा भर्जन।
उत्तर:
खनिज तथा अयस्क एवं निस्तापन तथा भर्जन में मुख्य अन्तर निम्नलिखित हैं-
| खनिज | अयस्क |
| 1. इसमें धातु की प्रतिशत मात्रा कम होती है। कुछ खनिजों को छोड़कर। | 1. सभी अयस्कों में धातु की प्रतिशत मात्रा पर्याप्त होती है। |
| 2. कुछ खनिजों में कुछ ऐसी अशुद्धियाँ होती हैं जो धातु के निष्कर्षण में बाधा डालती हैं। | 2. अयस्कों में ऐसी किसी भी प्रकार की अशुद्धियाँ नहीं होती हैं। |
| निस्तापन | भर्जन |
| निस्तापन के अन्तर्गत सान्द्रित अयस्क को वायु की अनुपस्थिति में उच्च ताप पर गर्म किया जाता है। | भर्जन के अन्तर्गत सान्द्रित अयस्क को वायु की नियन्त्रित मात्रा के साथ गर्म किया जाता है। |
दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
अयस्क सान्द्रण की झाग प्लवन विधि का सचित्र वर्णन कीजिए।
उत्तर:
अयस्क सान्द्रण की झाग प्लवन विधि – पानी के एक बड़े आयताकार बर्तन अयस्क को बारीक पीसकर डाल दिया जाता है। इसमें तारपीन या चीड़ का तेल मिला देते हैं। साथ ही अल्प मात्रा में प्लवन कारक पदार्थ मिला देते हैं और फिर हवा की तेज धारा भेजते हैं। शुद्ध सल्फाइड अयस्क झाग के साथ ऊपर तैरने लगता है। इसे वहाँ से अलग कर देते हैं। अशुद्धियाँ बर्तन के नीचे तली में बैठ जाती हैं।
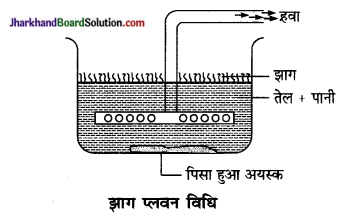
प्रश्न 2.
क्रायोलाइट का रासायनिक सूत्र दीजिए एवं हाल विधि में मिलाने का कारण बताइये। अथवा बॉक्साइट से ऐलुमिनियम प्राप्त करने की विधि में ऐलुमिना के शोधन के समय क्रायोलाइट क्यों मिलाया जाता है, कारण स्पष्ट कीजिए।
उत्तर:
क्रायोलाइट का रासायनिक सूत्र है- Na3AlF6। हाल की विधि में इसे मिलाने का प्रमुख कारण यह है कि शुद्ध ऐलुमिना विद्युत् का कुचालक है और 2050°C ताप पर पिघलता है। इस ताप पर ऐलुमिनियम वाष्प में बदल जाता है क्योंकि इसका क्वथनांक 1800°C है।
ऐलुमिना के विद्युत् अपघटन में क्रायोलाइट मिला देने पर क्रायोलाइट पिघलकर ऐलुमिना को अपने में घोल लेता है। अब विद्युत् धारा प्रवाहित करने पर 900°C से 950°C ताप पर ही ऐलुमिना गलित अवस्था में आ जाता और उसका अपघटन हो जाता है।
प्रश्न 3.
गालक क्या होते हैं? उदाहरण सहित समझाइये।
उत्तर:
गालक – अयस्क में उपस्थित गलनीय अपद्रव्यों को दूर करने के लिए प्रगलन करते समय मिलाये जाने वाले पदार्थों को गालक कहते हैं। ये दो प्रकार के होते
(1) अम्लीय गालक ऐसे गालक जो क्षारकीय अपद्रव्यों को दूर करने के लिए प्रयुक्त किये जाते हैं, अम्लीय गालक कहलाते हैं।
उदाहरण – सिलिका (SiO2)
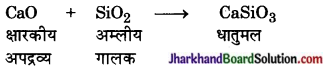
(2) क्षारीय गालक – ऐसे गालक जो अम्लीय अपद्रव्यों को दूर करने के लिए प्रयुक्त किये जाते हैं, क्षारीय गालक कहलाते हैं।
उदाहरण – कैल्सियम ऑक्साइड (CaO)

प्रश्न 4.
मिश्रधातु क्या है? एक मिश्रधातु का नाम, संघटन व उपयोग लिखिए।
उत्तर:
मिश्रधातु-दो या दो से अधिक धातुओं को पिघलाकर ठण्डा करने से जो समांग धातु मिश्रण मिलता है, उसे मिश्रधातु कहते हैं।
| मिश्र धातु | संघटन | उपयोग |
| स्टेनलेस स्टील | Cr = 11.5 % Ni = 2.5 % Fe = 86.5 % |
घर गृहस्थी के बर्तन, छुरी-काँट, वाल्व और मशीनों के पुर्जे बनाने में |
प्रश्न 5.
निस्तापन क्या है? बॉक्साइट तथा हेमेटाइट के निस्तापन को समझाइए।
उत्तर:
निस्तापन – सान्द्रित अयस्क को वायु की अनुपस्थिति में पिघलने से पूर्व ताप तक गर्म करने पर उसमें उपस्थित नमी, CO2, SO2 तथा अन्य वाष्पशील कार्बनिक अपद्रव्य निष्कासित हो जाते हैं यह क्रिया निस्तापन कहलाती है।
बॉक्साइट का निस्तापन- बॉक्साइट (AlgO3. 3H2O) का निस्तापन करने पर निर्जलीय Al2O3 प्राप्त होता है-

हेमेटाइट का निस्तापन- हेमेटाइट (Fe2O32H2O) का निस्तापन करने पर Fe2O3 प्राप्त होता है।
![]()
प्रश्न 6.
भर्जन क्या है? उदाहरण देकर समझाइए।
उत्तर:
भर्जन – सान्द्रित अयस्क को वायु या ऑक्सीजन की उपस्थिति में भट्टी में गलनांक से नीचे ताप पर गर्म करने की क्रिया भर्जन कहलाती है। यह मुख्यतः सल्फाइड अयस्कों में की जाती है।
उदाहरण – सल्फाइड अयस्क का भर्जन करने पर 8, As आदि की अशुद्धियाँ ऑक्साइड के रूप में निकल जाती हैं तथा अयस्क ऑक्साइड में बदल जाता है।
S + O2 → SO2
4As + 3O2 → 2As2O3
2PbS + 3O2 → 2PbO + 2SO2
![]()
प्रश्न 7.
प्रगलन क्या है? उदाहरण सहित समझाइए।
उत्तर:
प्रगलन – अयस्क में उचित गालक तथा कोक मिलाकर मिश्रण को उच्च ताप पर गलाने की क्रिया को प्रगलन कहते हैं।
इस क्रिया में गालक अशुद्धियों से मिलकर कम गलनांक का धातुमल बनाते हैं जो हल्का होने के कारण पिघली धातु की सतह पर आ जाता जिसे आसानी से पृथक किया जा सकता है।
उदाहरण – लोहे के धातुकर्म में सिलिका (SiO2) अपद्रव्य के रूप में उपस्थित होते हैं। इसमें गालक CaO मिलाकर प्रगलन करने पर कैल्सियम सिलिकेट नामक धातुमल बनाता है।
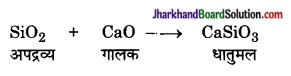
प्रश्न 8.
निस्तापन की क्रिया में अयस्क में होने वाले परिवर्तनों को लिखिए।
उत्तर:
निस्तापन की ‘क्रिया अयस्क में निम्नलिखित परिवर्तन होते हैं-
- अयस्क की भौतिक दशा बदल जाती है और वह सरन्ध्र हो जाता है जिससे वह अपचयन योग्य हो जाता है।
- नमी, क्रिस्टलन जल पृथक हो जाते हैं तथा अयस्क शुष्क हो जाता है।
- वाष्पशील अशुद्धियाँ सल्फर, फॉस्फोरस, ऑक्सीजन आदि पृथक हो जाती हैं।
- कार्बोनेट अयस्क ऑक्साइड में बदल जाते हैं।
प्रश्न 9.
भर्जन की क्रिया के दौरान अयस्क में होने वाले परिवर्तनों को लिखिए।
उत्तर:
भर्जन की क्रिया के दौरान अयस्क में निम्नलिखित परिवर्तन होते हैं-
- नमी पृथक हो और अयस्क शुष्क हो जाती जाता है।
- वाष्पशील अशुद्धियाँ जैसे- सल्फर, आर्सेनिक आदि वाष्पीकृत अथवा ऑक्सीकृत होकर अलग हो जाती हैं।
- सल्फाइड अयस्क ऑक्सीकृत होकर ऑक्साइड या सल्फेट में बदल जाता है।
- अयस्क सरन्ध्र हो जाता है जिससे आगे अपचयन सरलता होती है।
प्रश्न 10.
धातु के निष्कर्षण की ऐलुमिनो-तापी विधि का सचित्र वर्णन कीजिए एवं अभिक्रिया का रासायनिक समीकरण दीजिए।
उत्तर:
धातु के निष्कर्षण की इस विधि में धातु के ऑक्साइड और ऐलुमिनियम चूर्ण को मिलाकर एक क्रूसिबल में रखकर मैग्नीशियम के एक फीते, जिसके सिरे पर मैग्नीशियम चूर्ण और बेरियम परॉक्साइड मिश्रण की पोटली बँधी होती है, के द्वारा आग लगा देते हैं। ऊष्माक्षेपी क्रिया होने के कारण ताप लगभग 3000°C तक पहुँच जाता है। ऐलुमिनियम ऑक्साइड बनता है। धातु पिघलकर क्रूसिबल की तली में एकत्रित होने लगती है।
क्रोमियम और मैंगनीज के निष्कर्षण में इसी विधि का उपयोग होता है।
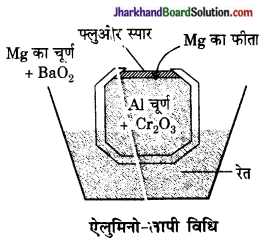
इसमें होने वाली रासायनिक अभिक्रिया का समीकरण निम्नलिखित है-
Cr2O3 + 2Al → Al2O3 + 2Cr + ऊष्मा
3MnO2 + 4Al → 3Mn + 2Al2O3 + ऊष्मा
धातु के अपद्रव्य को दूर करने के लिए गालक डाल दिया जाता है और धातुमल को अलग कर दिया जाता है।
प्रश्न 11.
लोहे पर जंग लगने की क्रिया को समझाइए।
अथवा
जंग का विद्युत रासायनिक सिद्धान्त लिखिए।
उत्तर:
जंग का विद्युत रासायनिक सिद्धान्त – इस सिद्धान्त के अनुसार अशुद्ध लोहे की सतह एक विद्युत रासायनिक सेल की भाँति व्यवहार करती है। ऐसे सेल को गैल्वनी सेल कहते हैं। इन सेलों में शुद्ध लोहा ऐनोड तथा अशुद्ध लोहा कैथोड की भाँति कार्य करता है। नमी, जिसमें ऑक्सीजन अथवा कार्बन डाइ ऑक्साइड विलेय है विद्युत अपघट्य का कार्य करती है। एनोड पर आयरन का फेरस आयनों में ऑक्सीकरण होता है और कैथोड पर जल का अपचयन होने से हाइड्रोजन गैस निकलती है।
एनोड पर अभिक्रिया-
Fe → Fe2+ + 2e– (ऑक्सीकरण)
कैथोड पर अभिक्रिया-
2H2O + 2e– → H2 + 2OH– (अपचयन)
फेरस आयनों (Fe2+) और हाइड्रॉक्साइड आयनों (OH–) के संयोग से फेरस हाइड्रॉक्साइड Fe (OH)2 बनता है, जिसे वायु फेरिक हाइड्रॉक्साइड में ऑक्सीकृत कर देती है। फेरिक हाइड्रॉक्साइड, हाइड्रेटेड फेरिक ऑक्साइड Fe2O3.xH2O में बदल जाता है जिसे जंग कहते हैं।
प्रश्न 12.
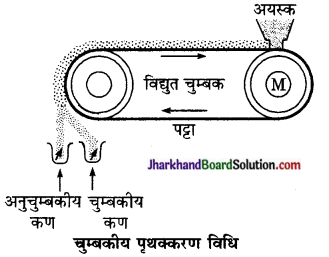
अयस्क सांद्रण की चुम्बकीय पृथक्करण विधि को सचित्र समझाइए।
उत्तर:
विद्युत चुम्बकीय पृथक्करण – अयस्क या अशुद्धि में से किसी एक का स्वभाव चुम्बकीय हो तो इस विधि का उपयोग करते हैं। इस विधि में बारीक अयस्क पट्टे पर विद्युत चुम्बकों के बीच, धीरे-धीरे खिसकाया जाता है जिससे चुम्बकीय पदार्थ थोड़ा खींचकर के नीचे तथा गैर-चुम्बकीय पदार्थ पट्टे से गिरकर थोड़ा आगे पृथक ढेर बनाते हैं। इस विधि से टिन स्टोन (SnO2)
से Fe3O4 और FeO4 आदि से सिलिकीय अशुद्धि हटाई जाती है
प्रश्न 13.
वात्याभट्ठी का सचित्र वर्णन कीजिए।
उत्तर:
वात्या भट्ठी – यह लोहे की बनी हुई भट्ठी होती है। इसके अन्दर अग्नि सह मिट्टी की ईंटों का अस्तर लगा होता है। इसके ऊपर चार्ज द्वार होता है जिसमें अयस्क,
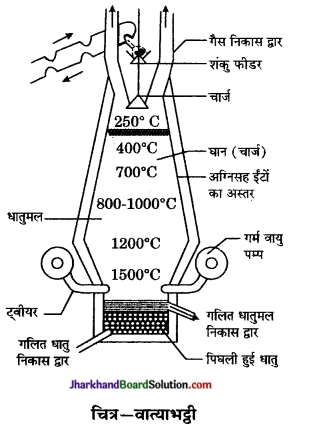
कोक तथा गालक का मिश्रण (चार्ज) गिराया जाता है। इसके बीच में हवायें भेजने के लिए ट्वायर लगे होते है। इसके बीच में हवायें भेजने के लिए ट्वायर लगे होते हैं। इसका ताप ऊपर से नीचे बढ़ता जाता है। धातु पिघलकर नीचे एकत्रित हो जाती है तथा उस पर धातुमल की परत रहती है। इन दोनों को अलग-अलग द्वारों से बाहर निकाल लिया जाता है। इसका उपयोग मुख्यतः लोहे के धातुकर्म में तथा इसके छोटे रूप में ताँबे के धातुकर्म में होता है।
प्रश्न 14.
खुली भट्टी प्रक्रम की विशेषताएँ तथा दोष लिखिए।
उत्तर:
खुली भट्टी प्रक्रम की विशेषताएँ-
- इस प्रक्रम से प्राप्त इस्पात उत्कृष्ट होता है।
- यह प्रक्रम अविरत है।
- इस प्रक्रम में ताप पर नियंत्रण किया जा सकता है।
खुली भट्टी प्रक्रम के दोष-
- यह प्रक्रम धीरे-धीरे सम्पन्न होता है। इसमें 10 घंटे लगते हैं।
- इस प्रक्रम में ज्वाला की गैसों से लोहे का ऑक्सीकरण रोकना कठिन है।
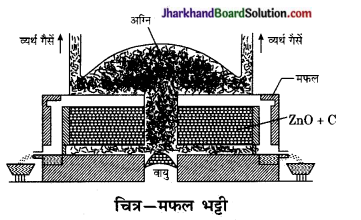
प्रश्न 15.
मफल भट्टी का सचित्र वर्णन कीजिए।
उत्तर:
मफल भट्ठी – इस भट्ठी में चूल्हा पूरी तरह ढका रहता है। गर्म गैसों से बाहर चारों ओर से प्रवाहित कर अयस्क को गर्म किया जाता है। इस प्रकार इस भट्ठी में न तो ईंधन और न ही ज्वाला अयस्क के सीधे सम्पर्क में आ पाते हैं यह उच्च ताप ईंटों के कक्ष में रहता है जिसे मफल कहते हैं। इस भट्टी का उपयोग प्रायः जिंक के निष्कर्षण होता है।
प्रश्न 16.
बॉक्साइट से शुद्ध ऐलुमिना प्राप्त करने की हाल का प्रक्रम का वर्णन कीजिए।
अथवा
बॉक्साइट से शुद्ध ऐलुमिना प्राप्त करने की किसी एक विधि का वर्णन कीजिए।
उत्तर:
प्रकृति से प्राप्त बॉक्साइट में Fe2O3, SiO2 आदि की अशुद्धियाँ होती हैं। अतः इसका शोधन आवश्यक हो जाता है। इसके शोधन से शुद्ध ऐलुमिना (Al2O3) प्राप्त होता है।
बॉक्साइट में उपस्थित अशुद्धियों के स्वभाव के आधार पर शोधन की निम्नलिखित तीन विधियाँ हैं-
- हाल का प्रक्रम
- बायर का प्रक्रम
- सर्पेक प्रक्रम।
हाल का प्रक्रम- जब बॉक्साइट में लोहे के ऑक्साइड (Fe2O3) तथा सिलिका (SiO2) की अशुद्धियाँ होती हैं तो यह प्रक्रम प्रयुक्त किया जाता है।
इस प्रक्रम में बॉक्साइट को बारीक पीसकर सोडियम कार्बोनेट (Na2CO3) के साथ प्रगलन करते हैं जिससे बॉक्साइट, सोडियम मेटाऐलुमिनेट (NaAlO2) में परिवर्तित हो जाता है। Fe2O3 व SiO2 अप्रभावित रहते हैं। Al2O3.2H2O + Na2CO3 → 2NaAlO2 + CO2 ↑ + 2H2O
प्राप्त गलित जल में उबालने पर सोडियम मेटा ऐलुमिनेट जल में घुल जाता तथा अशुद्धियाँ छानकर पृथक कर दी जाती हैं। प्राप्त छनित का ताप 50°-60°C करके इसमें CO2 गैस प्रवाहित की जाती है। इससे ऐलुमीनियम हाइड्रॉक्साइड अवक्षेपित हो जाता है।
2NaAlO2 + 3H2O + CO2 → Na2CO3 + 2Al(OH)3 ↓
प्राप्त अवक्षेप को छानकर जल से कई बार धो लेते हैं। तत्पश्चात् सुखा करके 1500°C पर निस्तापन करके निर्जल ऐलुमिना प्राप्त कर लेते हैं।
2Al(OH)3 → Al2O3 + 3H2O
प्रश्न 17.
धातुकर्म में प्रयुक्त होने वाली विद्युत भट्ठी का वर्णन कीजिए।
उत्तर:
विद्युत भट्ठी (Electric Furnace) – जहाँ विद्युत सस्ती होती है वहाँ इस प्रकार की भट्टियों का प्रयोग किया जाता है। ये मुख्यत: उच्च ताप पैदा करने तथा ऑक्सीकरण के लिए उपयोगी हैं। इनकी तीन किस्म होती हैं-
(i) प्रेरण भट्टी (Induction Furnace) – इस प्रकार की भट्टियों में क्रूसिबल, जिसमें घान (Charge) रहता है, द्वितीयक (Secondary) कुण्डली की तरह कार्य करती है। प्राथमिक परिपथ (Primary circuit) के टूटने तथा जुड़ने से उत्पन्न होने वाली प्रेरण धाराओं से पदार्थ गर्म होते हैं।
(ii) प्रतिरोधक भट्ठी (Resistance Fur nace) – इस प्रकार की भट्ठियों में विद्युत चक्र में प्रतिरोध (Resistance) के कारण उत्पन्न ऊष्मा का प्रयोग किया जाता हैं। अयस्क स्वयं ही प्रतिरोधक का कार्य कर सकता है।
(iii) आर्क भट्ठी (Are Furnace ) – इन भट्ठियों में ऊष्मा आर्को की सहायता से उत्पादित होती है। इसमें 3000°C तक ताप उत्पन्न किया जा सकता है। इसमें कार्बन इलेक्ट्रोडों का उपयोग किया जाता है। आर्क इलेक्ट्रोडों और अयस्क के मध्य उत्पन्न होता है।
(iv) अन्य जब कभी भट्टियों में चिमनियों से निकलने वाली गैसों की ऊष्मा का पुनः प्रयोग किया जाता है तो उन्हें पुनर्योजी भट्टी (Regenerative furnace) कहा जाता है। इसी प्रकार, यदि किसी भट्ठी में घूमता हुआ चूल्हा (Hearth) लगा हो तो वह परिक्रामी भट्टी (Revolving furnace) कहलाती है।
प्रश्न 18.
संक्षारण क्या है? इसको प्रभावित करने वाले कारक तथा संक्षारण से बचने के उपाय लिखिए।
अथवा
धातुओं के संक्षारण को प्रभावित करने वाले कारकों तथा उसके बचाव तरीकों का वर्णन कीजिए।
उत्तर:
संक्षारण – वायु अथवा रासायनिक पदार्थों [CO2, SO2, NO2 आदि] द्वारा धातुओं का धीरे-धीरे क्षय होना संक्षारण है। लौह पर जंग लगना एक प्रकार की संक्षारण प्रक्रिया है।
संक्षारण को प्रभावित करने वाले कारक-
- धातु की प्रकृति- किसी धातु की क्रियाशीलता जितनी अधिक होती है वह धातु उतनी ही अधिक शीघ्रता से संक्षारित होती है।
- अशुद्धियों की उपस्थिति – धातुओं में अशुद्धियों की उपस्थिति में छोटे-छोटे संक्षारण की दर बढ़ जाती है।
- वायुमण्डल की प्रकृति – वातावरण में यदि नमी, खारापन, CO2, SO2 SO3 आदि अशुद्धि के रूप में हैं तो संक्षारण की दर बढ़ जाती है।
- धातुओं में विकृति – धातुओं में विकृति जैसे खुरदरी सतह या मुड़ी हुई हों तो उन स्थानों पर उपस्थित परमाणुओं पर अणुओं में तनाव होता है। फलस्वरूप संक्षारण अधिक होता है।
- विद्युत अपघट्य की उपस्थिति-धातु वाले स्थान पर अम्ल, क्षार या लवणयुक्त जल जैसे विद्युत अपघट्य की उपस्थिति में संक्षारण की दर बढ़ जाती है।
संक्षारण से बचने के उपाय-
- धातु की सतह में पेंट लगाना चाहिए।
- धातु की सतह पर ग्रीस या तेल की पर्त लगानी चाहिए।
- धातु पर दूसरे धातु की पर्त चढ़ा देनी चाहिए।
प्रश्न 19.
अयस्क सान्द्रण के फेन प्लवन विधि का सिद्धान्त एवं विधि का विवरण लिखिए।
उत्तर:
अयस्क सान्द्रण की फेन प्लवन विधि का सिद्धान्त – यह विधि सल्फाइडों के सान्द्रण के लिए प्रयुक्त होती है। यह विधि इस सिद्धान्त पर आधारित है कि धात्विक सल्फाइड तेल द्वारा अपेक्षाकृत तेजी से आर्द्र (Wet) हो जाते हैं जबकि सिलिकेट अपद्रव्य जल द्वारा तेजी से आर्द्र होते हैं। जल-तेज मिश्रण में बने सल्फाइड अयस्क के (Suspension) में वायु धोंकने से तैलीय झाग बनता है जो धात्विक सल्फाइड अयस्क के कणों को अपने साथ तल पर ले आता है और मिट्टी, कंकड़, पत्थर आदि निलम्बन गैंग अपद्रव्य नीचे तली में चले जाते हैं। इस विधि द्वारा 1% अयस्क को 95% तक सान्द्रित किया जा सकता है।
फेन प्लवन विधि में प्रायः दो प्रकार के पदार्थ काम में आते हैं-
- फेन कारक (Frothing Agents) और
- प्लवन कारक (Floatation Agents)।
(a) फेन कारक (Frothing Agents ) – ये पदार्थ वायु- बुलबुलों के स्थायी फेन बनाने में सहायक होते हैं। चीड़ का तेल (Pine oil) और नीलगिरी तेल (Eucalyp- tus oil) अच्छे फेन कारक हैं।
(b) प्लवन कारक (Floatation Agents) – ये पदार्थ सल्फाइड अयस्क के कणों को जल प्रत्यकर्षी (Wa-ter repellent) बना देते हैं ताकि वे जल पर तैर सकें। किन्तु कैसे? आओ समझें-
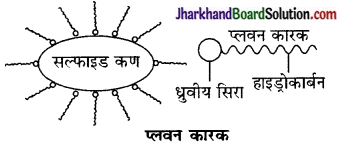
प्लवन कारक दो भागों मिलकर बने होते हैं-
- ध्रुवीय सिरा (Polar head) और
- हाइड्रोकार्बन पुच्छ (Hydrocarbon tail)।
इनके ध्रुवीय सिरे सल्फाइड अयस्क के कणों से चिपक जाते हैं तथा हाइड्रोकार्बन पुच्छ बाहर को फैल जाती है। इसके फलस्वरूप सल्फाइड कण तेल की बूँदों की भाँति व्यवहार करते हैं। अतः वायु के बुलबुलों द्वारा वे तल पर पहुँचते हैं और तैलीय झाग से जा मिलते हैं। प्लवन कारकों में सोडियम एथिल जैन्थेट या सोडियम ऐमिल जैन्थेट प्रमुख हैं।
इन्हें सूत्र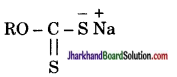 द्वारा व्यक्त कर सकते। यहाँ R-एथिल या ऐमिल समूह है। इन यौगिकों की अतिसूक्ष्म मात्रा (अयस्क के भार के लगभग 0.1%) ही काफी होती है।
द्वारा व्यक्त कर सकते। यहाँ R-एथिल या ऐमिल समूह है। इन यौगिकों की अतिसूक्ष्म मात्रा (अयस्क के भार के लगभग 0.1%) ही काफी होती है।
फेन – प्लवन विधि का विवरण- पानी के एक बड़े आयताकार बर्तन में अयस्क को बारीक पीसकर डाल दिया जाता है। इसमें तारपीन, चीड़ या नीलगिरी का तेल मिल
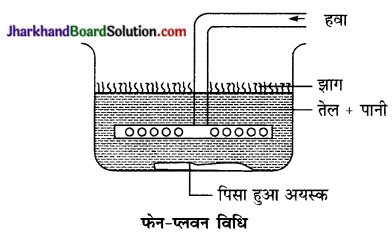
देते हैं। साथ ही अल्प मात्रा में प्लवन कारक पदार्थ मिलाते हैं और फिर हवा की प्रबल धारा भेजते हैं। शुद्ध सल्फाइड अयस्क झाग के साथ ऊपर तैरने लगता है। इसे वहाँ से अलग कर लेते हैं। मिट्टी, कंकड़, पत्थर आदि अपद्रव्य नीचे बैठ जाते हैं।
प्रश्न 20.
धातु क्या है? धातुओं के कोई चार सामान्य गुण समझाइये।
उत्तर:
धातु धातु वे तत्त्व हैं जिनमें स्वतंत्र इलेक्ट्रॉन होते हैं तथा जो अपने इलेक्ट्रॉन त्यागकर धनायन बनाते हैं।
Fe → Fe3+ + 3e–
Al → Al3+ + 3–
धातुओं के सामान्य गुण – धातुओं के सामान्य गुण निम्नलिखित हैं-
- संयोजी इलेक्ट्रॉन धातु परमाणु के बाह्यतम कोश में सामान्यतः 1, 2 अथवा 3 इलेक्ट्रॉन होते हैं। संयोजी इलेक्ट्रॉनों की संख्या जितनी कम होगी क्रियाशीलता उतनी ही अधिक होगी।
- अवस्था – सामान्य ताप पर सभी धातुएँ ठोस होती हैं। (Hg अपवाद है)
- पृष्ठीय चमक – सामान्यतः धातुओं की सतह पर पृष्ठीय चमक होती है।
- विद्युत धनी प्रकृति – जलीय विलयन में धातुएँ सहजता ‘इलेक्ट्रॉन त्यागकर धनायन बनाते हैं अतः ये इलेक्ट्रॉन धनी प्रकृति के होते हैं।
Na → Na+ + e–
Mg → Mg2+ + 2e–
Al → Al3 + 3e– - ऑक्साइड की प्रकृति-अधिकांश धातुओं के ऑक्साइडों की प्रकृति क्षारकीय होती है। ZnO, Al2 O3, तथा PbO की प्रकृति उभयधर्मी होती है।
![]()
प्रश्न 21.
बॉक्साइट से ऐलुमिनियम प्राप्त करने की सर्पेक विधि का निम्न बिन्दुओं के आधार पर वर्णन कीजिए-
(1) अयस्क का सूत्र
(2) समीकरण
(3) प्राप्त उत्पादों के नाम।
उत्तर:
(1) अयस्क का सूत्र- बॉक्साइट – Al2O3.2H2O
(2) समीकरण –

(3) प्राप्त उत्पादों के नाम-
- सिलिकन
- कार्बन मोनो ऑक्साइड
- ऐलुमिनियम नाइट्राइड
- ऐलुमिनियम हाइड्रॉक्साइड
- अमोनिया
प्रश्न 22.
(i) कॉपर को उसके अयस्क से निष्कर्षण हेतु पद नीचे दिए गए हैं। सम्बन्धित अभिक्रियाएँ लिखिए।
(a) कॉपर (I) सल्फाइड का भंजन
(b) कॉपर (I) ऑक्साइड के साथ कॉपर (I) सल्फाइड का अपचयन
(c) विद्युत अपघटनी परिष्करण
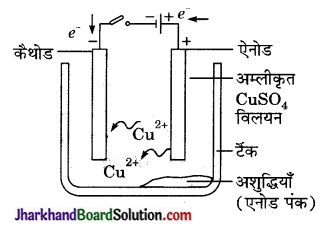
(ii) कॉपर के विद्युत अपघटनी परिष्करण के लिए एक स्वच्छ एवं नामांकित चित्र बनाइए।
उत्तर:
(i) (a) कॉपर (I) सल्फाइड का भंजन- केवल वायु में गर्म करके इसे अयस्क से अलग किया जा सकता है।

(b) पुन: CugO को CugS के साथ गर्म करने पर यह स्वतः अपचयित होकर कॉपर देता है।
![]()
(c) विद्युत अपघटनी परिष्करण- इस प्रक्रिया में अशुद्ध धातु को एनोड तथा शुद्ध धातु की पतली परत को कैथोड बनाया जाता है जब विद्युत अपघट्य अम्लीकृत CuSO4 से विद्युत धारा प्रवाहित की जाती है, तब एनोड पर स्थित अशुद्ध धातु धीरे-धीरे विद्युत अपघट्य में विलेय, हो जाती है तथा उतनी ही मात्रा में शुद्ध धातु विद्युत अपघट्य से कैथोड पर निक्षेपित हो जाती है। विलेय अशुद्धियाँ विलयन में चली जाती हैं तथा अविलेय अशुद्धियाँ एनोड तली पर निक्षेपित हो जाती हैं, जिसे एनोड पंक कहते हैं।- अभिक्रिया इस प्रकार होती है-
कैथोड पर-
Cu2+(aq) + 2e– → Cu(s);
ऐनोड पर – Cu(s) → Cu2+ (aq) + 2e–
(ii) कॉपर के विद्युत अपघटनी परिष्करण के लिए
बहुविकल्पीय प्रश्न
निर्देश: प्रत्येक प्रश्न में दिये गये वैकल्पिक उत्तरों में से सही विकल्प चुनिए-
1. ताँबे का अयस्क है-
(a) बॉक्साइट
(b) Cu2S
(c) CugO
(d) CuCO3.Cu (OH)2
उत्तर:
(b) Cu2S
2. कॉपर पाइराइट का सूत्र है-
(a) CuFeS2
(b) Cu2S
(c) Cus
(d) CuF
उत्तर:
(a) CuFeS2
3. मैट में मुख्यतः होता है-
(a) Fes
(b) Cu2S
(c) Cu2S तथा FeS
(d) Cu2S तथा Fe2S3
उत्तर:
(a) Fes
4. धातुओं का वह गुणधर्म जिसके कारण इससे पतले तार बनाए जाते हैं-
(a) ध्वनिक
(b) आघातवर्ध्यता
(c) तन्यता
(d) चालकता
उत्तर:
(c) तन्यता
5. Hgs का निष्कर्षण होता है-
(a) Hgs को गर्म कर, मर्क्यूरिक ऑक्साइड (HgO) प्राप्त कर और अधिक गर्म करने पर
(b) कार्बन द्वारा अपचयन से
(c) निस्तापन द्वारा
(d) थर्मिट अभिक्रिया द्वारा
उत्तर:
(a) Hgs को गर्म कर, मर्क्यूरिक ऑक्साइड (HgO) प्राप्त कर और अधिक गर्म करने पर
6. निम्नलिखित में से कौन-सी मिश्रधातु में मर्करी, उसके एक अवयव के रूप में होता है?
(a) स्टेनलेस स्टील
(b) ऐल्निको
(c) सोल्डर
(d) जिंक अमलगम
उत्तर:
(d) जिंक अमलगम
7. सामान्यतः अधातु विद्युत के चालक नहीं होते हैं। निम्नलिखित में से कौन-सा विद्युत का अच्छा चालक है?
(a) हीरा
(b) ग्रेफाइट
(c) सल्फर
(d) फुलेरीन
उत्तर:
(b) ग्रेफाइट
8. विद्युत तारों पर विद्युतरोधी पदार्थ की एक परत होती है। सामान्यतः उपयोग में लिए जाने वाला यह पदार्थ है-
(a) सल्फर
(b) ग्रेफाइट
(c) PVC
(d) सभी को प्रयोग में लिया जा सकता
उत्तर:
(c) PVC
9. धातुएँ सामान्यतः ठोस प्रकृति की होती हैं। निम्नलिखित में से कौन-सी धातु कमरे के ताप पर द्रव अवस्था में पायी जाती है?
(a) Na
(b) Fe
(c) Cr
(d) Hg
उत्तर:
(d) Hg
![]()
10. खाना पकाने के बर्तन बनाने में ऐलुमिनियम काम आता है। ऐलुमिनियम के कौन-से गुणधर्म इसके लिए उत्तरदायी हैं?
(i) उच्च ऊष्मीय चालकता
(ii) उच्च विद्युत चालकता
(iii) तन्यता
(iv) उच्च गलनांक
(a) (i) तथा (ii)
(b) (i) तथा (iii)
(c) (ii) तथा (iii)
(d) (i) तथा (iv)
उत्तर:
(d) (i) तथा (iv)
11. धातुएँ सामान्यतः क्षारीय ऑक्साइड बनाती हैं। निम्नलिखित में से कौन-सी धातु एक उभयधर्मी ऑक्साइड बनाती है?
(a) Na
(b) Ca
(c) Al
(d) Cu
उत्तर:
(c) Al
12. निम्नलिखित में से कौन-सी रासायनिक अभिक्रिया संपन्न होगी?
(a) MgSO4 + Fe
(b) ZnSO4 + Fe
(c) MgSO4 + Pb
(d) CuSO4 + Fe
उत्तर:
(d) CuSO4 + Fe
13. प्रगलन लिए Cu-अयस्क में सिलिका हटाता हैं।
(a) Cu2S
(b) Fe.S
(c) Fe2O3
(d) Cu2O
उत्तर:
(c) Fe2O3
14. कॉपर के प्रगलन में बेसेमर परिवर्तक का अस्तर होता है-
(a) सिलिका
(b) चूना
(c) लोहा
(d) कॉपर
उत्तर:
(b) चूना
15. फफोलेदार कॉपर है :
(a) कॉपर की एक मिश्रधातु
(b) कॉपर का एक यौगिक
(c) शुद्ध कॉपर
(d) लगभग 2% अशुद्ध कॉपर
उत्तर:
(d) लगभग 2% अशुद्ध कॉपर
16. मुद्रा धातु है-
(a) Zr
(b) Sn
(c) Ph
(d) Cu
उत्तर:
(d) Cu
17. अमलगम होते हैं-
(a) उपधात
(b) मिश्रधातु
(c) यौगिक
(d) विषमांगी मिश्रण
उत्तर:
(b) मिश्रधातु
18. निम्न में कौन-सी धातु अम्ल से हाइड्रोजन विस्थापित नहीं करती है-
(a) Fe
(b) Zn
(c) Cu
(d) Mg
उत्तर:
(c) Cu
19. क्लोराइड अयस्क का उदाहरण है-
(a) बॉक्साइट
(b) मैलेकाइट
(c) सीडेराइट
(d) हार्न सिल्वर
उत्तर:
(d) हार्न सिल्वर
20. निम्न में से कौन-सी धातु ठंडे जल से हाइड्रोजन गैस निकालती है-
(a) ताँबा
(b) सोना
(c) पोटैशियम
(d) ऐलुमिनियम
उत्तर:
(c) पोटैशियम
21. निम्न में से कौन-सी धातु अम्ल में से हाइड्रोजन विस्थापित करती है-
(a) Mg
(b) Cu
(c) Pt
(d) Hg
या
(a) Zn
(b) Cn
(c) Ag
(d) Hg
उत्तर:
(a) Mg
22. मुद्रा धातु है-
(a) Zn
(b) Ag
(c) Mg
(d) Na
उत्तर:
(b) Ag
23. जर्मन सिल्वर में कौन-सी धातु नहीं होती?
(a) Cu
(b) Zn
(c) Ag
(d) Ni
उत्तर:
(c) Ag
24. एण्टिमनी है-
(a) धातु
(b) अधातु
(c) उपधातु
(d) अक्रिय गैस
उत्तर:
(a) धातु
25. फफोलेदार ताँबे में कॉपर की प्रतिशत मात्रा है-
(a) 98
(b) 2
(c) 70
(d) 80
उत्तर:
(a) 98
26. ताम्र ग्लान्स का रासायनिक सूत्र है-
(a) Cu2S
(b) Cu2O
(c) CuFeS2
(d) CuCO3
उत्तर:
(a) Cu2S
रिक्त स्थानों की पूर्ति कीजिए-
- मिश्रधातु ………………… होते हैं।
- विद्युत अपघटनी परिष्करण में कैथोड ………………… बनाया जाता है।
- सबसे अभिक्रियाशील धातु ………………… है।
- ठंडे जल के साथ ………………… धातु तेज अभिक्रिया करती है
- सोने और प्लैटिनम को गलाने वाला अम्ल ………………… है
उत्तर:
- एक समांगी मिश्रण
- शुद्ध धातु की पतली पट्टी का
- सोडियम
- पोटैशियम
- ऐक्वारेजिया।